题目内容
15.有铁和锌的混合物共9.3g,与500mL盐酸恰好完全反应,在标准状况下共收集到3.36LH2,求:(1)铁的质量是2.8g;
(2)反应前,盐酸的物质的量浓度为0.6mol/L;
(3)写出锌与盐酸反应的离子方程式并用双线桥表示电子转移.
分析 (1)令铁和锌的物质的量分别为amol、bmol,利用二者质量之和与生成氢气的物质的量之和,列方程计算a、b的值,再根据m=nM计算铁的质量;
(2)根据H元素守恒计算出HCl的物质的量,再根据c=$\frac{n}{V}$计算出盐酸的浓度.;
(3)锌与盐酸反应生成锌离子和氢气,锌失电子,氢离子得电子,转移电子数为2e-.
解答 解:(1)令铁和锌的物质的量分别为amol、bmol,则:
Fe~~~~H2
amol amol
Zn~~~~H2
bmol bmol
所以$\left\{\begin{array}{l}{a+b=0.15}\\{56a+65b=9.3}\end{array}\right.$
解得:a=0.05,b=0.1
故混合物铁的质量为0.05mol×56g/mol=2.8g,
故答案为:2.8;
(2)标准状况下3.36L H2的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,所以根据H元素守恒,则HCl的物质的量为0.15mol×2=0.3mol,所以c=$\frac{n}{V}$=$\frac{0.3mol}{0.5L}$=0.6mol/L;
故答案为:0.6;
(3)锌与盐酸反应生成锌离子和氢气,其中锌失电子,氢离子得电子,转移电子数为2e-,所以用双线桥表示电子转移为: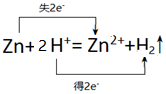 ,故答案为:
,故答案为: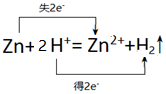 .
.
点评 本题考查常用化学计量的有关计算以及用双线桥表示电子转移,根据方程式进行的计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
5.下图是某些难溶或微溶物在常温下的饱和溶液中的离子浓度关系,其中pM表示阳离子的物质的量浓度的负对数,而pR表示阴离子物质担的负对数,据此分析下列说法中正确的是( )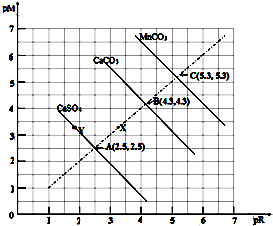

| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
3.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
20.废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是温度升高,H2O2分解速率加快.
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;.
4.下列物质置于1L水中充分搅拌后,溶液中阴离子种类最多的是( )
| A. | KCl | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgSO4 |
5.当可逆反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,通入18O2气体,再次达到平衡时18O存在于( )
| A. | SO2、O2、SO3中 | B. | SO3中 | C. | SO2、O2中 | D. | SO2、SO3中 |
 .
.