题目内容
2.下列对于“摩尔”的说法和理解正确的是( )| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 | |
| D. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
分析 A.物质的量是一种物理量;
B.物质的量的单位摩尔其符号为mol;
C.是以12C所含有的碳原子数为标准;
D.物质的量是把物质的宏观数量与微观粒子的数量联系起来的物理量.
解答 解:A.物质的量是一种物理量,是国际科学界建议采用的一种物理量,摩尔是单位,故A错误;
B.物质的量的单位摩尔其符号为mol,物质的量的符号为n,故B正确;
C.是以12C所含有的碳原子数为标准,即0.012kg12C所含有的碳原子数目为1mol,故C错误;
D.物质的量是把物质的宏观数量与微观粒子的数量联系起来的物理量,摩尔是物质的量的单位,不是物理量,故D错误.
故选B.
点评 本题考查了物质的量及其单位,掌握摩尔物质的量的单位、摩尔是单位不是物理量、使用摩尔时基本微粒应予指明等是正确解答本题的关键,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
13.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出].乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂.下列说法中正确的是( )


| A. | 若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件一定为减小压强 | |
| C. | 该容器的容积为2 L,B的起始物质的量为0.02 mol | |
| D. | t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g)?B(g)+2C(g)△H=-50a kJ•mol-1 |
10.下列说法正确的是( )
| A. | 活化分子间的碰撞一定是有效碰撞 | |
| B. | 活化分子具有的能量是活化能 | |
| C. | 活化分子的总数越多,反应速率越快 | |
| D. | 单位时间内有效碰撞次数越多,反应速率越快 |
7.Na2FeO4是一种高效多功能水处理剂一种制备Na2FeO4的方法可用化学方程式表示为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应说法不正确的是( )
| A. | Na2O2在反应中既作氧化剂又作还原剂 | |
| B. | O2是氧化产物 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 2molFeSO4发生反应时,共有12mol电子转移 |
14.常温,将100mL0.001mol/L的盐酸和50mLpH=3的硫酸溶液混合,所得溶液的pH为(混合过程溶液体积的变化忽略不计)( )
| A. | 2.7 | B. | 3.0 | C. | 4.5 | D. | 3.3 |
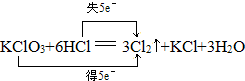 .
.