题目内容
2.在新制氯水中分别进行下列实验,写出相应的实验现象及反应的微粒.(1)在氯水中加入镁条,现象为:有气泡产生,镁条逐渐消失,反应微粒是:H+.
(2)将氯水滴加到AgNO3溶液中,现象为:产生白色沉淀,反应微粒是:Cl-.
(3)将红布条放入氯水中,现象为:红色布条褪色,反应微粒是:HClO.
(4)氯水中滴加紫色石蕊试液,现象为:溶液先变红,后褪色,微粒是:H+、HClO.
(5)将氯水滴加到FeCl2溶液中,现象为:溶液变为黄色,微粒是:Cl2.
分析 氯气溶于水,部分与水反应生成氯化氢和次氯酸,方程式:Cl2+H2O?HCl+HClO,所以新制氯水中存在Cl2、HClO、H2O、H+、Cl-、ClO-、OH-,根据物质的性质来分析解答.
(1)新制氯水溶液中存在氢离子,能够与镁反应生成氢气和镁离子;
(2)新制氯水溶液中存在氯离子,所以滴入硝酸银溶液产生白色氯化银沉淀;
(3)新制氯水溶液中存次氯酸,具有漂白性;
(4)新制氯水溶液中含有氢离子和次氯酸,既具有酸性,又具有漂白性;
(5)新制氯水溶液中存在氯气分子,具有强的氧化性.
解答 解:氯气溶于水,部分与水反应生成氯化氢和次氯酸,方程式:Cl2+H2O?HCl+HClO,所以新制氯水中存在Cl2、HClO、H2O、H+、Cl-、ClO-、OH-,
(1)新制氯水溶液中存在氢离子,能够与镁反应生成氢气和镁离子,所以看到现象为:有气泡产生,镁条逐渐消失,发生反应:Mg+2HCl═MgCl2+H2↑,
故答案为:有气泡产生,镁条逐渐消失;H+;
(2)新制氯水溶液中存在氯离子,所以滴入硝酸银溶液产生白色氯化银沉淀,反应微粒是Cl-;
故答案为:产生白色沉淀;Cl-;
(3)新制氯水溶液中存次氯酸,具有漂白性,能够使红色布条褪色,体现次氯酸的漂白性;
故答案为:红色布条褪色;HClO;
(4)新制氯水溶液中含有氢离子和次氯酸,盐酸具有酸性,能够使石蕊变红,次氯酸具有与漂白性,能够使变红的溶液褪色,
故答案为:溶液先变红,后褪色;H+、HClO;
(5)新制氯水溶液中存在氯气分子,具有强的氧化性,能够氧化二价铁离子生成三价铁离子,离子方程式:2Fe2++Cl2=2Fe3++2Cl-.,
故答案为:溶液变为黄色;Cl2.
点评 本题考查了元素化合物知识,熟悉氯水成分及所含微粒的性质是解题关键,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案| A. | 青铜是我国使用最早的合金 | |
| B. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面 |
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=1.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=90.0mol/(L•min) |
| A. | 2种 | B. | 7种 | C. | 10种 | D. | 12种 |
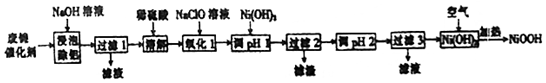
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(2)“溶解”时放出的气体为H2、H2S(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为ClO-+2Fe2++2H+=2Fe3++Cl-+2H2O.
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取8.29gxNiOOH•yNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010mol•L-1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4-+8H+═5Ni2++Mn2++4H2O,则x=8,y=1.