题目内容
17.写出下列反应的化学方程式,是离子反应的写离子方程式.(1)少量SO2气体通入到NaOH溶液中:SO2+2OH-=SO32-+H2O.
(2)过量SO2气体通入到澄清石灰水中:SO2+OH-=HSO3-.
(3)SO2气体通入到碘水中:SO2+I2+2H2O=SO42-+2I-+4H+.
(4)H2S气体与SO2气体混合:2H2S+SO2 =3S↓+2H2O.
(5)SO2和O2的反应:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3.
(6)SO2气体通入到少量Na2CO3溶液中2SO2+CO32-+H2O=CO2↑+2HSO3-.
分析 (1)少量SO2气体通入到NaOH溶液总反应生成亚硫酸钠和水;
(2)过量SO2气体通入到澄清石灰水中发生反应生成亚硫酸氢钙;
(3)SO2气体通入到碘水中发生氧化还原反应生成碘化氢和硫酸;
(4)H2S气体与SO2气体混合生成硫单质和水;
(5)SO2和O2在催化剂作用下加热反应生成三氧化硫;
(6)SO2气体通入到少量Na2CO3溶液中生成二氧化碳气体和亚硫酸氢钠;
解答 解:(1)少量SO2气体通入到NaOH溶液总反应生成亚硫酸钠和水,反应为离子反应,离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(2)过量SO2气体通入到澄清石灰水中发生反应生成亚硫酸氢钙为离子反应,反应的离子方程式为:SO2+OH-=HSO3-,故答案为:SO2+OH-=HSO3-;
(3)SO2气体通入到碘水中发生氧化还原反应生成碘化氢和硫酸,反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
(4)H2S气体与SO2气体混合生成硫单质和水,反应的化学方程式为:2H2S+SO2 =3S↓+2H2O,
故答案为:2H2S+SO2 =3S↓+2H2O;
(5)SO2和O2在催化剂作用下加热反应生成三氧化硫,反应的化学方程式为:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3,
故答案为:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3;
(6)SO2气体通入到少量Na2CO3溶液中生成二氧化碳气体和亚硫酸氢钠,反应的离子方程式为:2SO2+CO32-+H2O=CO2↑+2HSO3-,
故答案为:2SO2+CO32-+H2O=CO2↑+2HSO3-;
点评 本题考查了离子方程式、化学方程式的书写,明确反应实质是解题关键,注意化学式的拆分,题目难度不大.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9. 6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A. | ①的上层清液中含有Fe2+、Fe3+、Cu2+ | |
| B. | 硝酸的浓度为1mol•L-1 | |
| C. | 每份混合物中铁粉的质量为16.8g | |
| D. | ④中V=11.2L |
 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务.I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是银氨溶液,出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀.(用所学的知识回答)
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②溴与乙醛发生加成反应;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br-的物质的量.
(3)方案一是否可行否(填“是”或“否”),理由是 不论是发生取代反应还是发生氧化反应 溶液的酸性均增强.
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br-)=amol,则说明溴与乙醛发生取代反应.
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3-KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2.
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g.
试通过计算判断:溴与乙醛发生反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr.
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH.
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
| A. | 酒精灯在桌上歪倒失火后,立即用湿布盖灭 | |
| B. | 灭火,也用黄沙扑灭 | |
| C. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗 | |
| D. | 不慎将酸溅到眼中,应立即用干布擦去 |
| A. | 制取氧气时,用排水法收集氧气出现倒吸现象,立即打开试管上的橡皮塞 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
| A. | C3H8只表示一种物质的分子组成 | |
| B. | C2H6的一氯代物只有1种 | |
| C. | C3H8O能与钠反应放出H2的同分异构体有3种 | |
| D. | 丙烷的二氯代物有4种 |
| A. | 己烷有4种同分异构体,一定条件下能够发生取代反应 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应属于取代反应 | |
| D. | 聚合物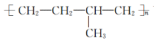 可由单体CH3CH═CH2和CH2═CH2加聚制得 可由单体CH3CH═CH2和CH2═CH2加聚制得 |