题目内容
1.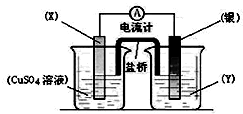 用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag
用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag(1)X应为Cu Y应为AgNO3溶液
(2)写出两个电极的电极反应式
X极Cu-2e-=Cu2+银极Ag++e-=Ag
(3)电池中电流的方向是由Ag极到Cu极
(4)当线路中通过0.2mol电子时,银极的质量增重(填增重或减轻)21.6g
(5)若将盐桥换成一根铜丝,也象盐桥一样插入两个烧杯中,则左边烧杯中新插入铜丝一极上发生的反应是Cu2++2e-=Cu.
分析 根据反应“Cu+2Ag+=Cu2++2Ag”分析,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,根据电极方程式计算Ag的质量,若将盐桥换成一根铜丝,也象盐桥一样插入两个烧杯中,则左边烧杯构成电解池,右侧是原电池,据此回答.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,X应为原电池的负极,为金属铜,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3溶液;
(2)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,X应为原电池的负极,为金属铜,反应为:Cu-2e-=Cu2+,金属银是正极,发生银离子得电子的还原反应,电极反应为:Ag++e-=Ag.
故答案为:Cu-2e-=Cu2+;Ag++e-=Ag;
(3)电流从正极流向负极,即由Ag流向Cu;
故答案为:Ag;Cu;
(4)当线路中通过0.2mol电子时,由电极反应Ag++e-=Ag可知,生成Ag为0.2mol,其质量为21.6g,则银电极增重21.6g;
故答案为:增重;21.6.
(5)若将盐桥换成一根铜丝,也象盐桥一样插入两个烧杯中,则左边烧杯构成电解池,右侧是原电池,金属银是正极,左侧铜丝是阴极,电极上发生的反应是
Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断和电极反应式的书写的方法,侧重于基础知识的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案①取少量吸收液于试管中,加入过量的稀盐酸,产生淡黄色浑浊和气体,将所得的气体依次通入品红溶液、足量酸性KMnO4溶液和澄清石灰水,品红褪色,石灰水变浑浊.
②另取少量待测液于试管中,加入过量的KClO3固体、AgNO3和稀硝酸,有白色沉淀产生.
③另取少量待测液于试管中,酸化后再加入淀粉KI溶液,呈蓝色.
④另取少量待测液于试管中,加入足量的BaCl2溶液和稀盐酸,有白色沉淀产生.
下列说法正确的是( )
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |

| A. | 菠萝酯不存在顺反异构现象 | B. | 原料中最多5个原子共线 | ||
| C. | 菠萝酯中所有的原子都可能共平面 | D. | 中间体和菠萝酯中均含手性碳原子 |
| A. | 漂白粉与浓盐酸反应可制取氯气 | |
| B. | 用FeS与稀硝酸制取硫化氢 | |
| C. | 浓硫酸与碘化钠共热制取碘化氢 | |
| D. | 用浓溴水除去苯中溶有的少量的苯酚 |


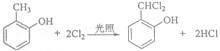 .
. (写结构简式).
(写结构简式).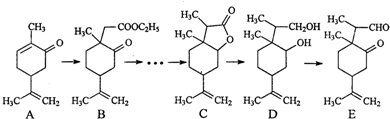
 (任写一种).
(任写一种).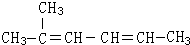 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.