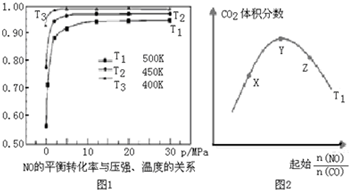
题目内容
15. A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答:
A、B、C、D、E为原子序数依次增大的五种短周期元素,A、B、C位于同一周期,C、E位于同一主族,A元素在自然界中形成的化合物种类最多,C元素的氢化物是最常用的溶剂,D元素在同周期元素中离子半径最小.请回答:(1)AC2的电子式
 ;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.
;D元素的最高价氧化物的水化物的电离方程式Al(OH)3?Al3++3OH-.(2)X、Y两种化合物是均由B、C与氢三种元素组成的,X能抑制水的电离,Y能促进水的电离,在一定条件下,X、Y可以相互转化.写出Y的化学式NH4NO3;X转化成Y的化学方程式NH3•H2O+HNO3=NH4NO3+H2O或NH3+HNO3=NH4NO3+H2O.
(3)下列各种溶液通入足量的EC2后,既无沉淀又无气体产生的有b种;
①Ba(OH)2②Ba(NO3)2③Na2S ④BaCl2⑤Ca(ClO)2⑥FeCl3⑦H2O2⑧氯水
a.3种 b.4种 c.5种 d.6种
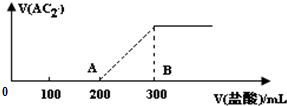
(4)向100mL3mol/L的NaOH溶液中缓缓通入一定量的AC2充分反应,测得最后溶液的pH>7.在上述所得溶液中缓慢滴加1mol/L的盐酸,所得气体的体积与盐酸的体积关系如图所示.
①B点时,产生的AC2在标准状况下的体积为2240mL;
②B点时,反应所得溶液中溶质的物质的量浓度是0.75mol•L-1(溶液体积变化忽略不计).
分析 A元素在自然界中形成的化合物种类最多,碳形成元素种类最多,所以A是碳元素,C元素的氢化物是最常用的溶剂是水,所以C是氧元素,D元素在同周期元素中离子半径最小是铝离子,所 以D是铝元素,而A、B、C位于同一周期,原子序数依次增大,所以B是氮元素,C、E位于同一主族,所以E是硫元素,由此分析解答.
解答 解:(1)AC2是二氧化碳电子式为: ;氢氧化铝电离后生成铝离子和氢氧根离子,电离方程式为Al(OH)3?Al3++3OH-,
;氢氧化铝电离后生成铝离子和氢氧根离子,电离方程式为Al(OH)3?Al3++3OH-,
故答案为 ;Al(OH)3?Al3++3OH-;
;Al(OH)3?Al3++3OH-;
(2)X、Y两种化合物是均由B、C与氢三种元素组成的,X能抑制水的电离,是酸或碱,结合题意X是硝酸,Y能促进水的电离,所以Y是含弱离子的盐,所以Y是硝酸铵,X转化成Y的化学方程式为:NH3•H2O+HNO3=NH4 NO3+H2O或NH3+HNO3=NH4 NO3+H2O,
故答案为:NH4NO3;NH3•H2O+HNO3=NH4 NO3+H2O或NH3+HNO3=NH4 NO3+H2O;
(3)下列各种溶液通入足量的二氧化硫后,既无沉淀又无气体产生的有
①Ba(OH)2足量的二氧化硫后生成亚硫酸钡,既无沉淀又无气体产生,故正确;
②Ba(NO3)2生成硫酸钡,不符合题意,故不符合;
③Na2S通入足量的二氧化硫后,生成单质硫,故不符合;
④BaCl2通入足量的二氧化硫后,不反应,故正确;
⑤Ca(ClO)2通入足量的二氧化硫后,生成硫酸钙,故不符合;
⑥FeCl3通入足量的二氧化硫后,生成单质硫,故不符合;
⑦H2O2通入足量的二氧化硫后,生成硫酸,故正确;
⑧氯水通入足量的二氧化硫后,生成硫酸和盐酸,故正确;
故选b;
(4)①根据反应方程式CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O可知,碳酸钠消耗盐酸的体积为100mL,则氢氧化钠消耗的盐酸体积也是100mL,即Na2CO3与NaOH的物质的量相等,根据钠离子守恒,则碳酸钠的物质的量为:$\frac{1}{3}$×(3mol/L×0.1L)=0.1mol,根据碳原子守恒,反应生成二氧化碳的物质的量为0.1mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L=2240mL,
故答案为:2240;
②B点时溶质为氯化钠,根据氢氧化钠的物质的量可知NaCl的物质的量为:0.1L×3mol/L=0.3mol,则NaCl的物质的量浓度是:$\frac{0.3mol}{0.3L+0.1L}$=0.75mol/L,
故答案为:0.75.
点评 本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分,注意在计算过程中守恒思想的应用.

 天天向上口算本系列答案
天天向上口算本系列答案| A. | 空气中电子式为${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量过多会造成温室效应 | |
| B. | 结构示意图为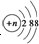 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的两种化合物均为常见的氧化剂 |
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数增加了 | D. | a<b+c |
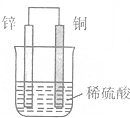
| A. | 锌片上有H2逸出 | B. | 溶液中c(H+)逐渐减小 | ||
| C. | 正极反应式:2H++2e-═H2↑ | D. | 负极反应式:Zn-2e-═Zn2+ |
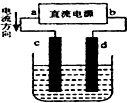
| A. | c、d电极上都有气体产生 | B. | d为阴极、c为阳极 | ||
| C. | d极附近溶液PH值升高 | D. | 电解过程中,氯离子浓度减小 |
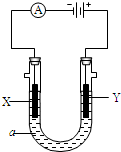 电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
电解原理在化学工业中有广泛应用,如图为工业制氯气的装置原理.U型管中装有电解液a;X、Y是两根电极棒,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液.请回答以下问题:
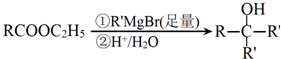
 .
. .
. .
. .
.