题目内容
(1)元素甲是第三周期ⅦA族元素,化合物A是由甲元素与另两种非金属元素组成的离子化合物,写出其电子式 ,其中化学键的类型为 .化合物A是由甲的氢化物与电解质B反应生成的,写出其在水溶液中反应的离子方程式: .
(2)在周期表中元素乙的非金属性最强,它的单质可以与水反应产生氧气,写出其反应的化学方程式: .
(3)金属元素丙形成的化合物通常用于鉴别CO2,则元素丙的离子与元素甲的简单离子的半径大小关系为 (用离子符号表示),比元素丙多15个质子的元素在周期表中的位置是 .
(2)在周期表中元素乙的非金属性最强,它的单质可以与水反应产生氧气,写出其反应的化学方程式:
(3)金属元素丙形成的化合物通常用于鉴别CO2,则元素丙的离子与元素甲的简单离子的半径大小关系为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)元素甲是第三周期ⅦA族元素是氯,甲元素与另两种非金属元素可组成离子化合物氯化铵,据此答题;
(2)最稳定的氢化物是氟化氢,据此写出氟气与水反应的化学方程式;
(3)氢氧化钙溶液常用于检验CO2,所以金属元素丙是钙元素,比较钙离子与氯离子的半径大小,电子层相同核电荷越多半径越小;比元素丙多15个质子的元素为溴元素,据此答题.
(2)最稳定的氢化物是氟化氢,据此写出氟气与水反应的化学方程式;
(3)氢氧化钙溶液常用于检验CO2,所以金属元素丙是钙元素,比较钙离子与氯离子的半径大小,电子层相同核电荷越多半径越小;比元素丙多15个质子的元素为溴元素,据此答题.
解答:
解:(1)元素甲是第三周期ⅦA族元素是氯,甲元素与另两种非金属元素可组成离子化合物氯化铵,氯化铵的电子式为: ,其中含有离子键和共价键,氯化氢与氨水反应的离子方程式为H++NH3?H2O═NH4++H2O,
,其中含有离子键和共价键,氯化氢与氨水反应的离子方程式为H++NH3?H2O═NH4++H2O,
故答案为: ;离子键、共价键;H++NH3?H2O═NH4++H2O;
;离子键、共价键;H++NH3?H2O═NH4++H2O;
(2)最稳定的氢化物是氟化氢,氟气与水反应的化学方程式为2F2+2H2O═4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(3)氢氧化钙溶液常用于检验CO2,所以金属元素丙是钙元素,比较钙离子与氯离子的半径大小,电子层相同核电荷越多半径越小,所以r(Ca2+)<r(Cl-),比元素丙多15个质子的元素为溴元素,位于元素周期表中第四周期 VIIA族,
故答案为:r(Ca2+)<r(Cl-);第四周期 VIIA族.
 ,其中含有离子键和共价键,氯化氢与氨水反应的离子方程式为H++NH3?H2O═NH4++H2O,
,其中含有离子键和共价键,氯化氢与氨水反应的离子方程式为H++NH3?H2O═NH4++H2O,故答案为:
 ;离子键、共价键;H++NH3?H2O═NH4++H2O;
;离子键、共价键;H++NH3?H2O═NH4++H2O;(2)最稳定的氢化物是氟化氢,氟气与水反应的化学方程式为2F2+2H2O═4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(3)氢氧化钙溶液常用于检验CO2,所以金属元素丙是钙元素,比较钙离子与氯离子的半径大小,电子层相同核电荷越多半径越小,所以r(Ca2+)<r(Cl-),比元素丙多15个质子的元素为溴元素,位于元素周期表中第四周期 VIIA族,
故答案为:r(Ca2+)<r(Cl-);第四周期 VIIA族.
点评:本题考查学生元素周期表和元素周期律的综合知识,要求学生具有分析和解决问题的能力,有一定的难度,解题的关键是元素的确定.

练习册系列答案
相关题目
下列化学用语表示正确的是( )
| A、质子数、中子数均为1的核素:1H |
| B、漂白粉的有效成分的化学式:CaClO |
C、Cl-的离子结构示意图: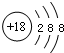 |
| D、碳酸钠的电离方程式:Na2CO3=2Na++CO32- |
迷迭香酸是从蜂花属植物中提取得到的酸性物质如图.下列取叙述正确的是( )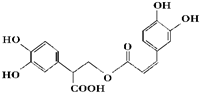

| A、迷迭香酸属于芳香烃 |
| B、1mol迷迭香酸最多能和含6mol NaOH的水溶液完全 |
| C、迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| D、1mol迷迭香酸最多能和9mol氢气发生加成反应 |
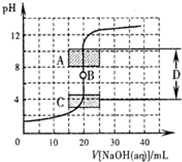 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其间溶液的pH变化是判断滴定终点的依据.