题目内容
短周期元素A、B、C、D.A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个未成对电子.
(1)若A为非金属元素,则A与C形成的化合物与A与D形成的化合物相比,稳定性为 > (填化学式).
(2)n=2时B的最高价氧化物对应水化物与当n=3时B的最高价氧化物对应水化物相比,二者酸性 > (填化学式).通过实验 加以证明.
(3)若A元素的原子最外层电子排布为2s1,B元素原子的价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示).
(1)若A为非金属元素,则A与C形成的化合物与A与D形成的化合物相比,稳定性为
(2)n=2时B的最高价氧化物对应水化物与当n=3时B的最高价氧化物对应水化物相比,二者酸性
(3)若A元素的原子最外层电子排布为2s1,B元素原子的价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P能级中有3个电子,则D元素原子电子排布式为1s22s22p63s23p3,故D为P元素,据此解答各小题即可.
解答:
解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P能级中有3个电子,则D元素原子电子排布式为1s22s22p6 3s23p3,故D为P元素,
(1)若A为非金属元素,则A为氢元素,非金属越强氢化物越稳定,故氢化物的稳定性:H2O>PH3,故答案为:H2O;PH3;
(2)当n=2时,B为碳元素;当n=3时B为Si;非金属越强其最高价氧化物的水化物酸性越强:H2CO3>H2SiO3,可通过强酸制取弱酸的反应加以证明;
故答案为:H2CO3;H2SiO3;强酸制取弱酸的反应;
(3)若A元素的原子最外层电子排布为2s1,B元素原子的价电子排布为3s23p2,则A为Li,B为Si;同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,故答案为:O>P>Si>Li.
(1)若A为非金属元素,则A为氢元素,非金属越强氢化物越稳定,故氢化物的稳定性:H2O>PH3,故答案为:H2O;PH3;
(2)当n=2时,B为碳元素;当n=3时B为Si;非金属越强其最高价氧化物的水化物酸性越强:H2CO3>H2SiO3,可通过强酸制取弱酸的反应加以证明;
故答案为:H2CO3;H2SiO3;强酸制取弱酸的反应;
(3)若A元素的原子最外层电子排布为2s1,B元素原子的价电子排布为3s23p2,则A为Li,B为Si;同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,故答案为:O>P>Si>Li.
点评:本题考查结构性质位置关系、核外电子排布规律、常用化学用语、元素周期律等,难度中等,注意基础知识的理解掌握.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、浓NaOH溶液与浓CaCl2溶液混合:Ca2++2OH-=Ca(OH)2↓ |
| B、氯化铝溶液中滴加氨水生成沉淀:Al3++3OH-=Al(OH)3↓ |
| C、利用醋酸溶解含碳酸钙的水垢CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、NaHSO4溶液中滴加NaHCO3溶液:2H++CO32-=CO2↑+H2O |
在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A、溶液中的Na+浓度增大,有O2放出 |
| B、溶液中的OH- 浓度不变,有H2放出 |
| C、溶液中的Na+数目减少,有O2放出 |
| D、溶液中的OH-浓度增大,有O2放出 |
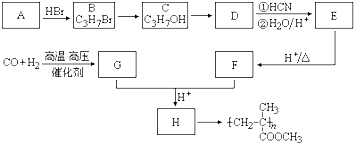
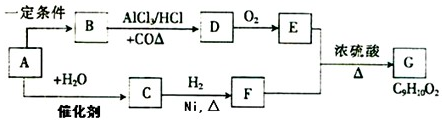
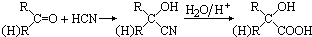 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成: