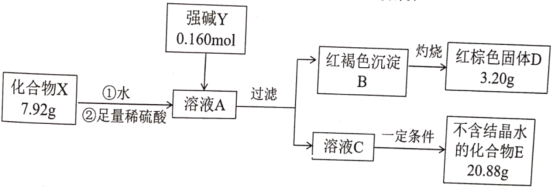
题目内容
【题目】下列浓度关系正确的是( )
A.向0.1mol/LNH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B.向0.1mol/L的KOH溶液中通入标准状况下的CO2气体3.36L,所得溶液中:c(K+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
C.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
【答案】D
【解析】
A. 向0.1mol/LNH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全,此时所用二者的体积刚好相同,生成BaSO4、NH3·H2O,溶液中主要发生NH3·H2O和H2O的电离,溶液中离子浓度关系为c(OH-)> c(NH![]() ),A错误;
),A错误;
B. 向0.1mol/L的KOH溶液中通入标准状况下的CO2气体3.36L,虽然不能确定生成何种物质,但 “c(K+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)”违背电荷守恒原则,所以B错误;
C. 因为电离能力CH3COOH>H2CO3>HCO3-,所以要产生相同浓度的OH-,应有下列关系:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),NaOH完全电离出OH-,所需浓度最小,从而得出pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(Na2CO3)<c(NaHCO3)<c(CH3COONa),C错误;
D. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液中,
c(HCN)=0.05mol/L,c(NaCN)=0.05mol/L,因为溶液呈碱性,所以主要发生以下反应:
CN-+H2O![]() HCN+OH-,H2O
HCN+OH-,H2O![]() H++OH-,从而得出:c(HCN) >c(Na+)>c(CN-)>c(OH-)>c(H+),D正确。
H++OH-,从而得出:c(HCN) >c(Na+)>c(CN-)>c(OH-)>c(H+),D正确。
故选D。

【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态