题目内容
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| C、将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀多于AgCl |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测反应热的数值偏小 |
考点:电解质与非电解质,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质,中和热的测定
专题:
分析:A、SO3溶于水后能导电,是三氧化硫溶于水生产了亚硫酸,三氧化硫是非电解质;
B、向NaAlO2溶液中滴加NaHCO3溶液,只有沉淀生成;
C、AgCl的溶解度大于AgBr的溶解度,两者的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀少于AgCl;
D、操作过程缓慢,导致热量散出损失.
B、向NaAlO2溶液中滴加NaHCO3溶液,只有沉淀生成;
C、AgCl的溶解度大于AgBr的溶解度,两者的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀少于AgCl;
D、操作过程缓慢,导致热量散出损失.
解答:
解:A、SO3溶于水后能导电,是三氧化硫溶于水生产了亚硫酸,三氧化硫是非电解质,故A错误;
B、向NaAlO2溶液中滴加NaHCO3溶液,只有氢氧化铝沉淀生成,不会生成二氧化碳气体,故B错误;
C、AgCl的溶解度大于AgBr的溶解度,两者的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀少于AgCl,故C错误;
D、操作过程缓慢,导致热量散出损失,所测反应热的数值偏小,故D正确,
故选D.
B、向NaAlO2溶液中滴加NaHCO3溶液,只有氢氧化铝沉淀生成,不会生成二氧化碳气体,故B错误;
C、AgCl的溶解度大于AgBr的溶解度,两者的饱和溶液等体积混合,再加入足量浓AgNO3溶液,生成的AgBr沉淀少于AgCl,故C错误;
D、操作过程缓慢,导致热量散出损失,所测反应热的数值偏小,故D正确,
故选D.
点评:本题主要考查的是盐类水解、溶解度大小关系的应用、中和热测定等,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
如图所示的电化学装置,下列叙述正确的是( )
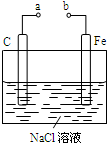

| A、a和b用导线连接,电子由碳经过导线流向铁 |
| B、a和b用导线连接,铁电极的电极反应为:Fe-3e-=Fe3+ |
| C、a、b分别连接直流电源正、负极,可以防止铁被腐蚀 |
| D、a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极移动 |
羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )
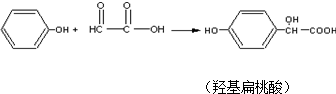

| A、苯酚和羟基扁桃酸互为同系物 |
| B、标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24 NA |
| C、乙醛酸只存在一种不同环境的氢原子 |
| D、羟基扁桃酸分子中至少有12个原子共平面. |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A、1 mol?L-1的甲酸溶液的c(H+)为1×10-2 mol?L-1 |
| B、甲酸能与水以任意比互溶 |
| C、10 mL 1 mol?L-1的甲酸溶液恰好与10 mL 1 mol?L-1的NaOH溶液完全反应 |
| D、滴入石蕊溶液显红色 |
下列推测或结论不合理的是( )
| A、X2-和Y+核外电子层结构相同,原子序数:X<Y |
| B、气态氢化物的稳定性HCl>HBr,还原性:Cl->Br- |
| C、硅、锗都位于金属与非金属的交界处,用途:都可以做半导体材料 |
| D、铷(37Rb)和锶(38Sr)分别位于第五周期IA和IIA族,碱性:RbOH>Sr(OH)2 |
水中加入下列溶液对水的电离平衡不产生影响的是( )
| A、NaHSO4溶液 |
| B、NaI溶液 |
| C、KAl(SO4)2溶液 |
| D、Na2CO3溶液 |
下列原理正确且离子方程式也正确的是( )
| A、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
| B、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O |
| C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| D、0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O |