题目内容
酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+ Cl2→2Cl-HNO3→NO.MnO4-→
Mn2+ 分别用等物质的量的这些物质氧化足量的KI,得到I2最多 的是( )
Mn2+ 分别用等物质的量的这些物质氧化足量的KI,得到I2最多 的是( )
| A、Fe3+ |
| B、HNO3 |
| C、Cl2 |
| D、MnO4- |
考点:化学方程式的有关计算
专题:计算题
分析:根据氧化还原反应中得失电子守恒的思想可知,在四个反应中氧化剂不一样,而还原剂均为碘化钾中的碘离子,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的也就是比较每1mol氧化剂得电子的多少,谁得电子多谁氧化的KI多,生成的I2就多.
解答:
解:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A.1molFe3+→Fe2+得1mole-,
B.1molHNO3→NO得3mole-;
C.1molCl2→2Cl-得2mole-,
D.1molMnO4-→Mn2+得5mole-,
显然D中1mol氧化剂得电子最多,生成的I2就最多,
故选D.
A.1molFe3+→Fe2+得1mole-,
B.1molHNO3→NO得3mole-;
C.1molCl2→2Cl-得2mole-,
D.1molMnO4-→Mn2+得5mole-,
显然D中1mol氧化剂得电子最多,生成的I2就最多,
故选D.
点评:本题考查氧化还原反应的计算,为高频考点,注意把握元素化合价的变化,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算,题目难度不大.

练习册系列答案
相关题目
要想使AlCl3溶液中的Al3+全部沉淀出来,应选用下列试剂中的( )
| A、NaOH溶液 | B、石灰水 |
| C、硫酸 | D、氨水 |
恒温恒压,不做功时,反应A+B═C+D,在下列哪种情况下,一定能自发进行( )
| A、△H<0,△S>0 |
| B、△H>0,△S>0 |
| C、△H<0,△S<0 |
| D、△H>0,△S<0 |
如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )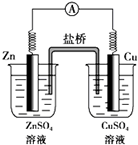

| A、反应中,盐桥中的Cl-会移向ZnSO4溶液 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、铜片上有气泡逸出 |
| D、锌为负极,发生还原反应,电极反应式为:Zn-2e-=Zn2+ |
现有乙酸、环己烷、辛烯组成的混合物,其中氧的质量分数为a,则碳的质量分数是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
有关化学用语不正确的是( )
| A、CO2分子的结构式:O=C=O | ||
B、O-18的原子符号:
| ||
C、S2-离子的结构示意图: | ||
D、氯化氢分子的电子式: |
某温度下,向容积为20L的密闭反应器中充入0.2molHI(g),达到平衡后测得HI的转化率为80%,则该温度下反应H2(g)+I2(g)?2HI(g)的平衡常数是( )
| A、2.5×10-2 |
| B、0.25 |
| C、4.0 |
| D、4.0×102 |
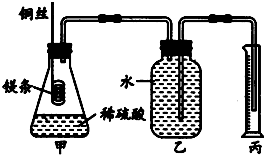 化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).
化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).