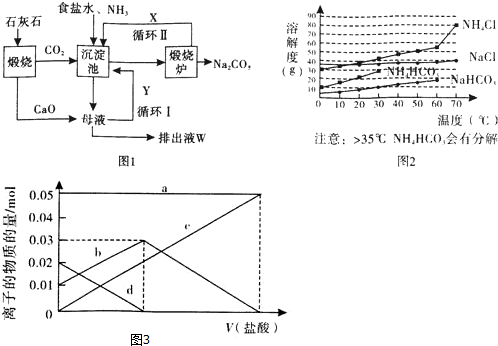
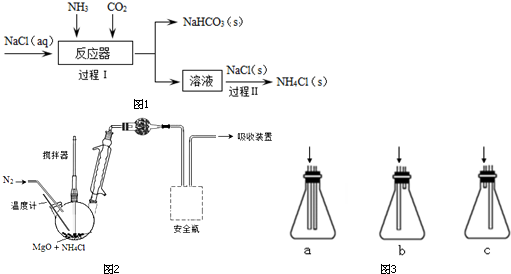
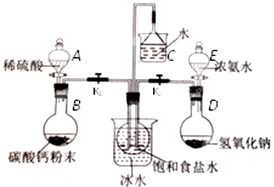
题目内容
17.(1)白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.①已知298K时白磷、红磷完全燃烧的热化学方程式分别为
P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJ•mol-1
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1
则该温度下白磷转化为红磷的热化学方程式为P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol.
②已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ•mol-1):P--P 198,Cl--Cl 243,P--Cl 331.

则反应P4(s,白磷)+6Cl2(g)═4PCl3(s)的反应热△H=-1326kJ/mol.
(2)下列两个热化学方程式:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2220kJ•mol-1
①H2的燃烧热△H=-285.8kJ/mol.
②1molH2和0.5molC3H8组成的混合气体完全燃烧释放的热量为1395.8kJ.
分析 (1)①P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol(I),
P(s,红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s)△H2=-738.5kJ/mol(Ⅱ)
由盖斯定律可知(I)-(Ⅱ)×4可得:P4(s,白磷)=4P(s,红磷);
②焓变等于反应物转化键能之和减去生成物中键能之和;
(2)①燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,且物质的量与热量成正比;
②由H2和C3H8的燃烧热,结合物质的量与热量成正比计算.
解答 解:(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol(I),
P(s,红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s)△H2=-738.5kJ/mol(Ⅱ)
由盖斯定律可知(I)-(Ⅱ)×4可得:P4(s,白磷)=4P(s,红磷),则△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol;
即热化学方程式为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
②已知白磷和PCl3的分子结构如图所示,由提供以下化学键的键能(kJ•mol-1):P-P 198,Cl-Cl 243,P-Cl 331.则反应P4(白磷,s)+6Cl2(g)═4PCl3(s)的反应热△H=198kJ/mol×6+6×243kJ/mol-4×3×331kJ/mol=-1326kJ/mol;
故答案为:-1326kJ/mol;
(2)①燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则1mol氢气完全燃烧生成液态水放出的热量为285.8kJ,则氢气的燃烧热为△H=-285.8kJ/mol,
故答案为:-285.8kJ/mol;
②由氢气的燃烧热为△H=-285.8kJ/mol,丙烷燃烧热△H=-2220kJ/mol,可知1mol 氢气和0.5mol丙烷的混合气完全燃烧时放热为285.8kJ/mol×1mol+2220kJ/mol×0.5mol=1395.8kJ,
故答案为:1395.8kJ.
点评 本题考查反应热与焓变,为高频考点,把握盖斯定律应用、焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律及燃烧热的判断,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①X被氧化
②X是氧化剂
③X具有氧化性
④XY既是氧化产物也是还原产物
⑤XY中的Y2-具有还原性
⑥XY中的X2+具有氧化性
⑦Y的氧化性XY中的X2+氧化性强.
以上叙述正确的是( )
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
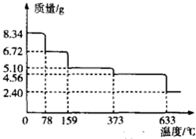 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:(1)在FeCl3饱和溶液中滴加饱和纯碱溶液可观察到有红褐色沉淀和气泡生成,写出该反应的离子方程式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(2)工业上应用铁矿石冶炼金属铁时涉及的反应有:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47.2kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+640.5kJ•mol-1
写出CO还原FeO的热化学方程式:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
(3)绿矾(FeSO4•7H2O)在受热条件下不稳定,易发生分解.现取绿矾样品8.34g,在隔绝空气的条件下加热,样品质量随着温度的变化曲线如图所示.
159℃时的固体物质的化学式为FeSO4•H2O;633℃时分解除生成固体物质外,还有两种气体物质,且这两种气体物质的密度之比为4:5,则633℃时分解的化学方程式为2FeSO4$\frac{\underline{\;633℃\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(4)已知密闭容器中发生反应:Fe(S)+CO2(g)?FeO(s)+CO(g)△H>0.测得在不同温度下,该反应的平衡常数随温度的变化数据如表所示.
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
a.1.47、2.40 b.2.40、1.47 c.0.64、0.48d.0.48、0.64
②500℃时,在容积为2L的密闭容器中放入2mol铁粉和2mol CO2,若测得10min时反应达到平衡状态,则0~10min内的平均反应速率v(CO2)=0.05mol/(L•min).
③800℃时,在反应达到平衡状态后,要使反应速率减小且平衡逆向移动,可采取的措施有减小二氧化碳的物质的量(或者降低温度)(写出一种即可).
(5)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌和病毒,在对水的消毒和净化过程中,不产生任何对人体有害的物质,其消毒和除污效果比含氯消毒剂要好.高铁酸钠的制备方法之一是电解:Fe+2H2O+2OH-$\frac{\underline{\;通电\;}}{\;}$FeO42-+3H2↑,电解质溶液选用NaOH溶液.该电解池的阳极反应式为Fe+8OH--6e-=FeO42-+4H2O.
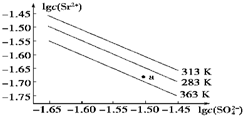
| A. | 温度一定时,Ksp(SrSO4)随c(SO42- )的增大而减小 | |
| B. | 三个不同温度中,313 K时Ksp(SrSO4)最大 | |
| C. | 283 K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |