题目内容
15.下列叙述正确的是( )| A. | 可用分液漏斗分离溴和四氯化碳 | |
| B. | CH3COOCH3核磁共振氢谱中只给出一种信号 | |
| C. | 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为碳链异构体 | |
| D. | 与氢气加成得到2,3-二甲基戊烷的烯烃结构式有5种 |
分析 A、溴能溶于四氯化碳;
B、此有机物为乙酸甲酯,两个甲基位置不同;
C、乙醇中官能团为羟基,二甲醚中官能团为醚键;
D、烯烃与氢气加成得到2,3-二甲基戊烷,则甲基位于2号、3号碳原子上,与碳碳双键键的位置无关,以此来解答.
解答 解:A、溴能溶于四氯化碳,两者不能分层,故不能利用分液漏斗分离,故A错误;
B、此有机物为乙酸甲酯,两个甲基位置不同,有2种不同化学环境的H原子,故B错误;
C、乙醇中官能团为羟基,二甲醚中官能团为醚键,二者属于官能团异构,故C错误;
D、烯烃与氢气加成得到2,3-二甲基戊烷,则甲基位于2号、3号碳原子上,与碳碳双键键的位置无关,则碳碳双键可能只能在1、2号之间,2、3号之间,3、4号之间,4、5号之间,或者3号碳与其所连的甲基上,故总共有5种,故D正确,故选D.
点评 本题主要考查的是混合液的分类、官能团异构、同分异构体判断等,综合性较强,有一定的难度,需要认真整理.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
5.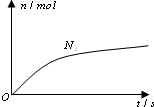 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
6.下列说法正确的是( )
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
3.下列有关金属腐蚀与防护的说法不正确的是( )
| A. | 钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-═4OH- | |
| B. | 当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
10.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 上述电解过程中共转移2 mol电子 | |
| B. | 原混合溶液中c(K+)为2 mol/L | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol/L |
7.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
17.X、Y、Z三种元素的原子,其核外电子排布分别为:X最外层有1个电子,Y有3个电子层,最外层电子数比次外层的少3,Z的最外层电子数是次外层的3倍.由这三种元素组成的化合物的化学式不可能是( )
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X3YZ3 |
 ;
; 下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题:
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题: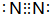 .
.