题目内容
6.下列说法正确的是( )| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
分析 A.根据决定了该原子的化学性质的为价电子数判断;
B.根据原子序数可以推知质子数、电子层数以及最外层电子数等;
C.具有相同质子数,不同中子数同一元素的不同原子互为同位素;
D.H中不含中子.
解答 解:A.因为决定了该原子的化学性质的为价电子数,所以原子核外电子排布决定了该原子的化学性质,故A正确;
B.根据原子序数可以推知电子层数以及最外层电子数,电子层数=周期序数,最外层电子数=主族序数,可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置,但不能确定该原子的中子数,故B错误;
C.质子数不同,为不同元素的原子,不是同位素关系,故C错误;
D.H的原子核中没有中子,故D错误.
故选A.
点评 本题考查原子结构与元素性质,难度不大,明确元素周期表及其规律是解本题关键.

练习册系列答案
相关题目
16.S2Cl2在合成橡胶、硬水软化等方面有着重要应用.将Cl2通入熔融的硫黄可制得S2Cl2,S2Cl2是黄红色油状发烟液体,遇水分解出无色有刺激性气味的气体,且溶液变浑浊.有关叙述正确的是( )
| A. | 在周期表中,氯元素位于硫元素之后,所以Cl2的氧化性弱于硫单质 | |
| B. | 硫黄中只有非极性键,S2Cl2中只有极性键 | |
| C. | 在常温常压下,硫黄是原子晶体,S2Cl2是分子晶体 | |
| D. | S2Cl2与水反应时,既体现氧化性又体现还原性 |
17.已知乙炔、苯、乙醛的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
| A. | 84% | B. | 60% | C. | 91% | D. | 无法计算 |
1.五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品.回答下列问题:
①E元素在元素周期表中的位置是第二周期IVA族.
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是PH3(用化学式表示).
③F、X、Z形成的简单离子半径从大到小顺序为Cl->N3->Na+(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程: .
.
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是同素异形体.
①E元素在元素周期表中的位置是第二周期IVA族.
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是PH3(用化学式表示).
③F、X、Z形成的简单离子半径从大到小顺序为Cl->N3->Na+(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程:
 .
.⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是同素异形体.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
11.原电池产生电流的本质原因是( )
| A. | 原电池中电解质溶液能电离出自由移动的离子 | |
| B. | 有两根导线将两个活动性不同的电极连接 | |
| C. | 电极上进行的氧化还原反应的生成物为电子 | |
| D. | 电极上进行氧化还原反应时有电子的定向移动 |
15.下列叙述正确的是( )
| A. | 可用分液漏斗分离溴和四氯化碳 | |
| B. | CH3COOCH3核磁共振氢谱中只给出一种信号 | |
| C. | 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为碳链异构体 | |
| D. | 与氢气加成得到2,3-二甲基戊烷的烯烃结构式有5种 |
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.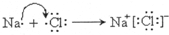 .
.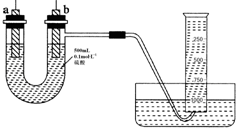 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气. .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.