题目内容
7.2SO2(g)+O2(g)$?_{△}^{V_{2}O_{5}}$2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
分析 根据催化剂可以同等程度的增大正逆反应的反应速率;增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;并利用降低温度反应速率减小及化学反应速率的计算式来解答.
解答 解:A、催化剂可同等程度的改变正、逆反应的反应速率,但不能改变转化率,故A错误;
B、若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B错误;
C、一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),不符合速率之比等于化学计量数之比,故C错误;
D、根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为 $\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$,故D正确;
故选D.
点评 本题主要考查了影响化学反应速率的因素,化学反应速率和化学平衡是化学基本理论的核心知识,既是重点又是难点,也是年年必考的内容,特别是有关化学反应速率和化学平衡的计算及影响因素、化学平衡常数的表达式及其计算是高考的重点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.已知乙炔、苯、乙醛的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
| A. | 84% | B. | 60% | C. | 91% | D. | 无法计算 |
15.下列叙述正确的是( )
| A. | 可用分液漏斗分离溴和四氯化碳 | |
| B. | CH3COOCH3核磁共振氢谱中只给出一种信号 | |
| C. | 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为碳链异构体 | |
| D. | 与氢气加成得到2,3-二甲基戊烷的烯烃结构式有5种 |
2.下列含有非极性键的共价化合物是( )
| A. | H2 | B. | Na2O2 | C. | H2O2 | D. | CH4 |
12.化学与环境密切相关.下列有关说法错误的是( )
| A. | CO、NO能与人体的血红蛋白结合,使人中毒 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 光化学烟雾会引起呼吸道疾病 | |
| D. | CO2、NO2或SO2都会导致酸雨的形成 |
19.下列离子在溶液中可以大量共存的一组是( )
| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
9.下表是元素周期表的一部分,有关说法正确的是 ( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VⅠA | VⅡA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | a、b、e、f四种元素的原子半径:e>f>b>a | |
| B. | h、i两种元素阴离子的还原性:h>i | |
| C. | a、g两种元素氢化物的稳定性:g>a | |
| D. | d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 |
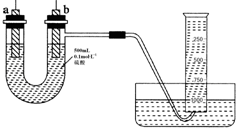 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气. .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.