题目内容
炒过菜的铁锅未及时洗净(残液中含有NaCl),不久便会因腐蚀而出现红褐色锈斑.试回答:
(1)铁锅的锈蚀应属于 ,腐蚀的原因是 .
(2)铁锅锈蚀的电极反应式为:负极 ;正极 .正负极反应产物会继续发生反应,反应的离子方程式和化学方程式为 .
(1)铁锅的锈蚀应属于
(2)铁锅锈蚀的电极反应式为:负极
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:(1)铁锅中含有Fe、C,Fe、C和电解质溶液构成原电池,中性条件下,钢铁发生吸氧腐蚀;
(2)该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,据此分析解答.
(2)该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,据此分析解答.
解答:
解:(1)铁锅中含有Fe、C,Fe、C和电解质溶液构成原电池,Fe易失电子作负极而加速被腐蚀,所以铁锅的锈蚀属于电化学腐蚀,
故答案为:电化学腐蚀;Fe、C和电解质溶液构成原电池而加速Fe的腐蚀;
(2)该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+、正极反应式为O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为Fe2++2OH-=Fe(OH)2、化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe-2e-=Fe2+;O2+2H2O+4e-=4OH-;Fe2++2OH-=Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:电化学腐蚀;Fe、C和电解质溶液构成原电池而加速Fe的腐蚀;
(2)该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe-2e-=Fe2+、正极反应式为O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧气氧化生成氢氧化铁,离子反应方程式为Fe2++2OH-=Fe(OH)2、化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe-2e-=Fe2+;O2+2H2O+4e-=4OH-;Fe2++2OH-=Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查金属腐蚀与防护,明确原电池原理是解本题关键,知道金属防止被腐蚀的方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
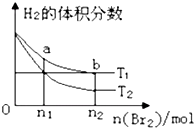 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)?2HBr(g)△H<0. 当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)?2HBr(g)△H<0. 当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A、由图可知:T2>T1 |
| B、a、b两点的反应速率:b>a |
| C、为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D、T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
如图示装置是化学实验室的常用装置,它有多种用途.以下各项用途的操作都正确的是( )
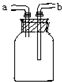

| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集不溶于水的气体:瓶内充满水,由a进气 |
| C、提供少量CO:瓶内充满CO,a接自来水龙头 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为BrCl+H2O=HCl+HBrO,关于BrCl叙述错误的是( )
| A、固态溴化碘是由极性键构成的分子晶体 |
| B、和NaOH溶液反应生成NaCl和NaBrO |
| C、能使湿润的淀粉碘化钾试纸变蓝 |
| D、与水反应时BrCl既是氧化剂又是还原剂 |
有关甲、乙、丙、丁四个图示的叙述正确的是( )


| A、甲中负极反应式为2H++2e-═H2↑ |
| B、乙中阳极反应式为Ag++e-═Ag |
| C、丙中H+向碳棒方向移动 |
| D、丁中电解开始时阳极产生黄绿色气体 |
下列说法正确的是( )
| A、pH=0 的溶液不存在 |
| B、中性溶液的c(H+)不一定等于10-7 |
| C、溶液稀释时,pH值减小 |
| D、用湿润的pH试纸测定某溶液的pH |
下列实验基本操作中,主要是出于实验安全考虑的是( )
| A、实验剩余的药品不能放回原试剂瓶 |
| B、点燃可燃性气体前的验纯 |
| C、气体实验装置在实验前进行气密性检查 |
| D、胶头滴管不能交叉使用 |
某些地区的水中可能含有少量下列盐类.当用新买来的铝锅或铝壶烧水时,遇到水的地方会变成灰黑色,据此可以判断此地的水中含有( )
| A、钠盐 | B、钾盐 | C、钙盐 | D、铁盐 |