题目内容
将5.6g铁粉投入足量的100mL 2mol/L稀硫酸中,2min时铁粉刚好完全溶解.下列有关这个反应的反应速率表示不正确的是( )
| A、铁的反应速率=0.5mol/(L?min) |
| B、硫酸的反应速率=0.5mol/(L?min) |
| C、硫酸亚铁的反应速率=0.5mol/(L?min) |
| D、氢气的反应速率=0.5mol/(L?min) |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:5.6g铁粉的物质的量为:
=0.1mol,故参加反应的硫酸的物质的量为0.1mol,生成硫酸亚铁的物质的量为0.1mol,硫酸的反应速率=
=0.5mol/(L?min),结合反应速率之比等于化学计量数之比来解答.
| 5.6 |
| 56 |
| ||
| 2 |
解答:
解:5.6g铁粉的物质的量为:
=0.1mol,故参加反应的硫酸的物质的量为0.1mol,生成硫酸亚铁的物质的量为0.1mol,
A.铁为固体,不能用于表示反应速率,故A错误;
B.硫酸的反应速率=
=0.5mol/(L?min),故B正确;
C.硫酸亚铁的反应速率=硫酸的反应速率=0.5mol/(L?min),故C正确;
D.氢气为气体,必须在密闭容器中方可用于表示反应速率,故D错误;
故选AD.
| 5.6 |
| 56 |
A.铁为固体,不能用于表示反应速率,故A错误;
B.硫酸的反应速率=
| ||
| 2 |
C.硫酸亚铁的反应速率=硫酸的反应速率=0.5mol/(L?min),故C正确;
D.氢气为气体,必须在密闭容器中方可用于表示反应速率,故D错误;
故选AD.
点评:本题考查化学反应速率的相关计算及表示方法,难度不大.要注意固体不能用于表示反应速率及用气体表示反应速率的条件.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
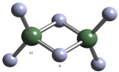 科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )
科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )| A、Al2H6中H为+1价,Al为-3价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6分子是非极性分子 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
下列说法正确的是( )
| A、当7.8g Na2O2与H2O完全反应时,有0.2mol电子发生了转移 |
| B、将1.5molBr2通入2molFeI2溶液中的离子方程式3Br2+2I-+4Fe2+═2Br-+I2+2Fe3+ |
| C、用浓盐酸酸化KMnO4溶液以增强其氧化性 |
| D、在3NO2+H2O═2HNO3+NO中,氧化剂和还原剂的质量比为1:2 |
下列说法不正确的是( )
| A、除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B、铅蓄电池在放电时,Pb作为负极,不断转化为PbSO4 |
| C、用盐酸酸化KMnO4溶液可以增强其氧化性 |
| D、强电解质在水中溶解度不一定大于弱电解质在水中的溶解度 |
某化学反应达到化学平衡:A(g)+3B(g)?2C(g)(△H<0),将气体混合物的温度降低,下列叙述中正确的是( )
| A、正反应速率和逆反应速率都变小,平衡向正反应方向移动 |
| B、正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| C、正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 |
| D、正反应速率和逆反应速率都变小,平衡向逆反应方向移动 |
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙、丁四个容器体积均为2L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
下列判断中,正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 | α1 | α2 | α3 | |
| A、乙中SO3的平衡转化率为α1=20% |
| B、平衡时,丙中c(SO3)是甲中的2倍 |
| C、平衡时,α3<α1 |
| D、该温度下,平衡常数的值为400 |
下列有机物的名称正确的是( )
| A、3-氯丙烷 |
| B、2-甲基-2-乙基丁烷 |
| C、3-丁烯 |
| D、2,3-二甲基戊烷 |
下列离子方程式书写正确的是( )
| A、过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 |
| B、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| C、NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
 有光学活性,分别发生下列反应:①与甲酸发生酯化反应②与氢氧化钠水溶液共热③与银氨溶液作用④在催化剂存在下与氢气作用.生成的有机物中无光学活性的是( )
有光学活性,分别发生下列反应:①与甲酸发生酯化反应②与氢氧化钠水溶液共热③与银氨溶液作用④在催化剂存在下与氢气作用.生成的有机物中无光学活性的是( )