题目内容
17.下列离子方程式书写正确的是( )| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 向次氯酸钙溶液通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液:NH4++OH-=NH3↑+H2O |
分析 A.电荷不守恒;
B.二氧化碳少量,反应生成碳酸钙和次氯酸;
C.氯化氢为强电解质,应拆成离子形式;
D.氢氧化钠过量,碳酸氢根离子、氨根离子都反应;
解答 解:A.钠与水反应,离子方程式:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.向次氯酸钙溶液通入少量CO2,离子方程式:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,故B正确;
C.实验室用MnO2和浓盐酸制取Cl2,离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl-+Cl2↑+2H2O,故C错误;
D.向NH4HCO3溶液中加过量的NaOH溶液,离子方程式:HCO3-+NH4++2OH-=NH3•H2O+H2O+CO32-,故D错误;
故选:B.
点评 本题考查了离子方程式书写正误判断,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
相关题目
7.已知甲、乙、丙、X是中学化学中四种常见的物质,其转化关系如图所示.则甲和X不可能是( )
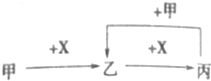
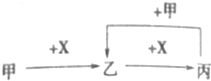
| A. | 甲为CO2,X为NaOH溶液 | B. | 甲为NH3,X为O2 | ||
| C. | 甲为Si,X为O2 | D. | 甲为NaAlO2,X为HCl溶液 |
8.下列有关化学用语正确的是( )
| A. | 二氧化碳的结构式:O-C-O | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | F原子结构示意图: | |
| D. | MgCl2的电子式: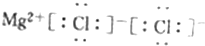 |
5.下列说法正确的是( )
| A. | 配制一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,使配制的溶液浓度偏小 | |
| B. | pH试纸使用时不需要润湿,红色石蕊试纸检测气体时也不需要润湿 | |
| C. | 蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| D. | 石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,再继续加热蒸馏 |
12.下列关于含硫化合物的叙述不正确的是( )
| A. | SO2能与CaO反应,可用生石灰作工业废气的脱硫剂 | |
| B. | SO2能使碘的淀粉溶液由蓝色变为无色,体现出漂白性 | |
| C. | 浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性 | |
| D. | 医疗上曾用硫酸钡作X射线透视肠胃的内服药剂 |
2.某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
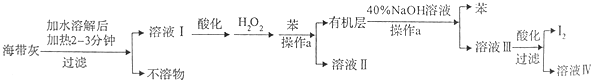
(1)溶解海带灰时要加热煮沸2~3min的目的是加快I-溶解,使海带灰中I-尽可能全部溶解,操作a的名称为分液.
(2)向酸化的溶液I中加入H2O2的目的为将I-氧化为I2.
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式3I2+6NaOH=NaIO3+5NaI+3H2O.
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是C(填选项字母).
A.水 B.乙醇 C.冷水 D.乙醇的水溶液
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI.取5.0g产品,配制成100ml溶液.取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0,.050mol•L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示.
滴定时,达到滴定终点的现象是加入最后一滴标准溶液后,蓝色溶液恰好变为无色且半分钟内不褪色,碘单质在产品中的质量分数是25.4%(用百分数表示,且保留1位小数).

(1)溶解海带灰时要加热煮沸2~3min的目的是加快I-溶解,使海带灰中I-尽可能全部溶解,操作a的名称为分液.
(2)向酸化的溶液I中加入H2O2的目的为将I-氧化为I2.
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式3I2+6NaOH=NaIO3+5NaI+3H2O.
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是C(填选项字母).
A.水 B.乙醇 C.冷水 D.乙醇的水溶液
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI.取5.0g产品,配制成100ml溶液.取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0,.050mol•L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/ml | 10.00 | 10.00 | 10.00 |
| 消耗Na2S2O3标准溶液的体积/ml | 19.95 | 17.10 | 20.05 |
2.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | 稀豆浆 | B. | 氯化钠溶液 | C. | CuSO4溶液 | D. | KMnO4溶液 |
19.下列物质有固定元素组成的是( )
| A. | 空气 | B. | 干冰 | C. | 氨水 | D. | 氯酸钾 |
20.根据下列实验,不能证明一元酸HR为弱酸的是( )
| A. | 室温下,NaR溶液的pH大于7 | |
| B. | 25℃时,0.01mol/L的HR溶液pH=2.8 | |
| C. | 加热NaR溶液时,溶液的pH变小 | |
| D. | HR溶液加入少量NaR固体,溶解后溶液的pH变大 |