题目内容
20.7.5毫升0.1摩尔/升AgN03溶液跟5毫升0.05摩尔/升RClx溶液完全反应,则RClx溶液中Cl-物质的量浓度为0.15mol/L.分析 根据反应Ag++Cl-=AgCl↓,可知n(Ag+)=n(Cl-),据此计算RClx溶液中Cl-物质的量浓度.
解答 解:7.5mL 0.1mol/L的AgNO3溶液中n(Ag+)=0.0075L×0.1mol/L,
根据反应Ag++Cl-=AgCl↓,可知n(Ag+)=n(Cl-),
所以c(Cl-)×0.005L=0.0075L×0.1mol/L,
解得c(Cl-)=0.15mol/L,
故答案为:0.15mol/L.
点评 本题考查离子方程式的计算,题目难度不大,明确发生的反应即可解答,旨在考查相等对基础知识的理解掌握.

练习册系列答案
相关题目
10.只含SiO2杂质的CaCO3样品,在高温煅烧后,残余物为一纯净物,则原样品中SiO2的质量分数是( )
| A. | 40% | B. | 28.6% | C. | 37.5% | D. | 62.5% |
11.下列氧化物既能跟稀硫酸反应又能跟氢氧化钠溶液反应的是( )
| A. | Fe2O3 | B. | CO2 | C. | Al2O3 | D. | MnO2 |
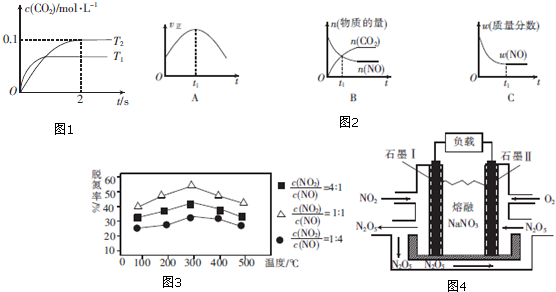
8. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
(1)体系中发生反应的化学方程式是2X+2Y?2Z+W;
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
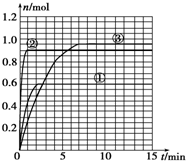
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.| t/min | X/mol | Y/mol | Z/mol | W/mol |
| 0 | 2.00 | 1.00 | 0.00 | 0.00 |
| 1 | 1.80 | 0.80 | 0.20 | 0.10 |
| 3 | 1.50 | 0.50 | 0.50 | 0.25 |
| 5 | 1.30 | 0.30 | 0.70 | 0.35 |
| 9 | 1.10 | 0.10 | 0.90 | 0.45 |
| 10 | 1.10 | 0.10 | 0.90 | 0.45 |
| 14 | 1.10 | 0.10 | 0.90 | 0.45 |
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
15.某种硬铝合金是由 Al、Cu、Mg三种金属组成,主要应用于耐热可焊的结构件及锻件.某研究小组欲探究该合金的性质并测定合金中铝的质量分数:
(1)甲同学预测:该合金与10mol/L硝酸反应时有NO2气体生成,可能还有NO生成.
查阅资料:常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.设计如下装置进行实验.按图连接装置并检验气密性后,称取5g 合金放于圆底烧瓶中,并滴加10mol/L硝酸.
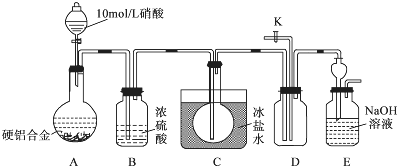
①合金中Cu与稀硝酸反应的离子方程式是3Cu+2NO3-+8H+=Cu2++2NO↑+4H2O.
②C装置的目的是将生成的NO2冷凝为N2O4,与NO分离,排除干扰.
③能证明有NO生成的实验操作与现象是打开活塞K,鼓入空气,若D中的气体由无色变为红棕色,证明有NO生成.
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10mol/L硝酸反应时没有NO生成.乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是在加入HNO3前,通入N2,除尽装置中的空气.
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
pH>7.8时,Al(OH)3开始溶解,pH>10.8时沉淀完全溶解.
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是pH≥12.4.
②选用NaOH溶液调节pH,得到溶液B的离子方程式是Al3++4OH-=AlO2-+2H2O.
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是90%.
(1)甲同学预测:该合金与10mol/L硝酸反应时有NO2气体生成,可能还有NO生成.
查阅资料:常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.设计如下装置进行实验.按图连接装置并检验气密性后,称取5g 合金放于圆底烧瓶中,并滴加10mol/L硝酸.

①合金中Cu与稀硝酸反应的离子方程式是3Cu+2NO3-+8H+=Cu2++2NO↑+4H2O.
②C装置的目的是将生成的NO2冷凝为N2O4,与NO分离,排除干扰.
③能证明有NO生成的实验操作与现象是打开活塞K,鼓入空气,若D中的气体由无色变为红棕色,证明有NO生成.
④实验进行至A中固体全部溶解后,未检验到有NO生成,甲同学认为硬铝合金与10mol/L硝酸反应时没有NO生成.乙同学认为不能确定是否生成了NO,需补充操作才能证明,该操作是在加入HNO3前,通入N2,除尽装置中的空气.
(2)为测定合金中铝的质量分数,丙同学查阅资料:
部分金属离子生成氢氧化物沉淀的pH
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |
设计如下方案并进行实验:

①调节pH时,应控制pH的范围是pH≥12.4.
②选用NaOH溶液调节pH,得到溶液B的离子方程式是Al3++4OH-=AlO2-+2H2O.
③Al(OH)3经过滤、洗涤、灼烧至恒重后称量,质量为8.5g,则该合金中铝的质量分数是90%.
5.X、Y、Z三种元素原子序数依次增大,X与Z同主族,Y与Z同周期,Z的单质通常为黄绿色气体,Z与Y能形成YA型化合物,下列说法正确的是( )
| A. | 在元素周期表中,Y所在族的元素都是活泼金属元素 | |
| B. | 37Z原子核电子数为20 | |
| C. | X与Y能形成YX型化合物 | |
| D. | 在常温下,Z的单质与氢气一定能大量共存 |
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.