题目内容
1.下列离子方程式书写正确的是( )| A. | 小苏打中加入过量的澄清石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 偏铝酸钠溶液中通入过量的CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- | |
| C. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O | |
| D. | Fe(NO3)2溶液中加入过量的HI溶液:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
分析 A.石灰水过量,反应生成碳酸钙、氢氧化钠和水;
B.二氧化碳过量,反应生成碳酸氢钠;
C.二者发生氧化还原反应,亚硫酸根离子被氧化;
D.碘化氢过量,碘离子和硝酸根离子发生氧化还原反应.
解答 解:A.向澄清石灰水中加入少量小苏打溶液反应生成碳酸钙沉淀,反应的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O,故A错误;
B.偏铝酸钠溶液中通入过量二氧化碳,反应生成了氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B错误;
C.Na2SO3溶液使酸性KMnO4溶液褪色,离子方程式:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故C正确;
D.Fe(NO3)2溶液中加入过量的HI溶液,离子方程式为:2NO3-+8H++6I-=3I2+2NO↑+4H2O,故D错误;
故选:C.
点评 本题考查反应方程式的书写,侧重考查复分解反应、氧化还原反应离子方程式书写,明确发生的化学反应是解答本题的关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
13.下列说法正确的是( )
| A. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| B. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 | |
| C. | 红外光谱分析不能区分乙醇和乙酸乙酯 | |
| D. | 蛋白质溶液中加硫酸铵或氯化铜溶液,均会发生蛋白质的变性 |
10.一定条件下,某反应在恒容密闭容器中发生,容器内各物质的浓度随时间的变化如图所示(所有物质均为气体),下列说法正确的是( )


| A. | 该反应的方程式A+B?C | |
| B. | t1时刻反应达到平衡状态 | |
| C. | t2时刻,正反应速率大于逆反应速率 | |
| D. | 0~30min,用B表示该反应速率为0.03mol•L-1•min-1 |
6.关于中和热测定实验的下列说法不正确的是( )
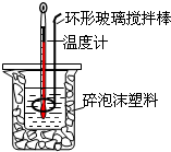

| A. | 使用环形玻璃棒既可以搅拌又避免损坏温度计 | |
| B. | 测了酸后的温度计要用水清洗后再测碱的温度 | |
| C. | 向盛装酸的烧杯中加碱时要小心缓慢以免洒出 | |
| D. | 改变酸碱的用量,所求中和热数值不变 |
13.2SO2(g)+O2(g)?2SO3(g)是制备硫酸的重要反应之一.其他条件不变时,改变下列影响化学反应速率的一个条件,可以加快反应速率的是( )
| A. | 使用催化剂 | B. | 减小反应体系的压强 | ||
| C. | 降低反应体系的温度 | D. | 将SO3从体系中分离出来 |
10.下列有关描述正确的是( )
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 雷电能固氮属于自然固氮,而工业合成氨及氨的催化氧化均属于人工固氮 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
11.下列元素中,非金属性最强的是( )
| A. | 氟 | B. | 氧 | C. | 氩 | D. | 碳 |