题目内容
【题目】硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
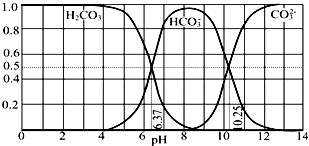
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
【答案】 ![]() 10% 增大接触面积,提高反应速率 SeO2+2SO2+2H2O=2H2SO4+Se↓ 过滤 Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- 偏低 Te4++2SO2+4H2O=Te+8H++2SO42- H2SO4、HCl
10% 增大接触面积,提高反应速率 SeO2+2SO2+2H2O=2H2SO4+Se↓ 过滤 Na2TeO3 TeO32-+3H2O+4e-=Te+6OH- 偏低 Te4++2SO2+4H2O=Te+8H++2SO42- H2SO4、HCl
【解析】(1)Se与O属于同族元素,氢化物的电子式为![]() 。设电离的亚碲酸为xmol/L,(H2TeO3)的Ka1=1×10-3=
。设电离的亚碲酸为xmol/L,(H2TeO3)的Ka1=1×10-3= =
=![]() ,解得x=0.01,则0.1mol/L的H2TeO3电离度=
,解得x=0.01,则0.1mol/L的H2TeO3电离度=![]() ×100%=10%,故答案为:
×100%=10%,故答案为:![]() ;10%;
;10%;
(2)加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,可以增大接触面积,提高反应速率,故答案为:增大接触面积,提高反应速率;
(3)根据流程图,SeO2与SO2在冷却后通入水中反应生成Se,反应的化学方程式为SeO2+2SO2+2H2O=2H2SO4+Se↓。Se单质难溶于水,反应后分离出Se单质可以通过过滤分离,故答案为:SeO2+2SO2+2H2O=2H2SO4+Se↓;过滤;
(4) TeO2微溶于水,易溶于较浓的强酸和强碱。焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为Na2TeO3。工业上也可以通过电解溶液①得到单质碲,电解时的电极均为石墨,则阴极发生还原反应,TeO32-得到电子生成Te,电极反应式为TeO32-+3H2O+4e-=Te+6OH-,故答案为:Na2TeO3;TeO32-+3H2O+4e-=Te+6OH-;
(5) TeO2微溶于水,易溶于较浓的强酸和强碱。向溶液①中加入硫酸时控制溶液的pH为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致生成的TeO2沉淀偏少,碲的回收率偏低,故答案为:偏低;
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,二氧化硫被氧化生成硫酸,反应的离子方程式为Te4++2SO2+4H2O=Te+8H++2SO42-,故答案为:Te4++2SO2+4H2O=Te+8H++2SO42-;
(7)根据流程图和上述(6)的方程式可知,Te4++2SO2+4H2O=Te+8H++2SO42-反应中生成的盐酸和硫酸可以循环利用,故答案为:H2SO4、HCl。

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案