��Ŀ����
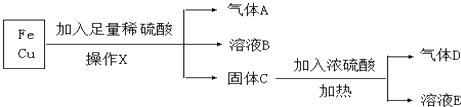
����Ŀ�������º�̼����H2CO3��HCO3����CO32��������CO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�����������ҺpH�Ĺ�ϵ��ͼ��ʾ������˵��������ǣ������� 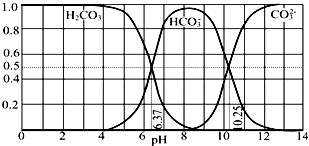
A.pH=10.25ʱ��c��Na+���Tc��CO32����+c��HCO3����
B.Ϊ��þ����ܴ���NaHCO3 �� �˿�����Һ��pHΪ7��9֮��
C.����ͼ�����ݣ����Լ���õ�H2CO3��һ�������ƽ�ⳣ��K1��H2CO3��=10��6.37
D.����0.1mol NaOH ��Ӧ�����õ�1L��Һ��pH=10ʱ����Һ�д������¹�ϵ��c��Na+����c��HCO3������c��CO32������c��OH������c��H+��
���𰸡�A
��������A������ͼʾ��֪��pH=10.25ʱ����Ϊ̼���ƺ�̼�����ƣ����������غ��жϣ�
B������ͼʾ��֪��pH��7��9֮����Ҫ����̼��������ӣ�
C������pH=6.37ʱ̼��������Ӻ�̼���Ũ����ȼ��㣻
D��pH=10ʱ��Һ�ʼ��ԣ���c��OH������c��H+����c��Na+������Ũ������ͼ�����߱仯���ж�c��HCO3������c��CO32�����Ĵ�С��
�⣺A��pH=10.25ʱ������Ϊ̼���ƺ�̼�����ƣ�̼������Һ�����������غ㣺c��Na+���T2c��CO32����+2c��HCO3����+2c��H2CO3����̼��������Һ�д��������غ㣺c��Na+��=c��CO32����+c��HCO3����+c��H2CO3��������Һ��c��Na+����c��CO32����+c��HCO3��������A����
B������ͼʾ��֪��pH��7��9֮�䣬��Һ����Ҫ����HCO3������pH��Χ�ںͻ�ýϴ���NaHCO3����B��ȷ��
C������ͼ�����߿�֪��pH=6.37ʱ��H2CO3��HCO3����Ũ����ȣ�̼��ĵ�һ�������ƽ�ⳣ��K1��H2CO3��= ![]() =10��6.37����C��ȷ��
=10��6.37����C��ȷ��
D��pH=10ʱ����ҺΪ���ԣ���c��OH������c��H+��������Ϊ̼���ƺ�̼�����ƣ�c��Na+������Ũ������ͼ�����߱仯��֪��c��HCO3������c��CO32��������ʱ����Ũ�ȴ�СΪ��c��Na+����c��HCO3������c��CO32������c��OH������c��H+������D��ȷ��
��ѡA��

����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ����ݣ�
�¶�/�� | 25 | t1 | t2 |
ˮ�����ӻ����� | 1��10��14 | �� | 1��10��12 |
�Իش��������⣺
��1����25��t1��t2 �� ���1��10��14���������������=�������������жϵ������� ��
��2��25���£�ijNa2SO4��Һ��c��SO42����=5��10��4 molL��1 �� ȡ����Һ1mL����ˮϡ����10mL����ϡ�ͺ���Һ��c ��Na+����c ��OH����= ��
��3��t2���£���pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=2����V1��V2= �� ����Һ�и������ӵ�Ũ���ɴ�С������˳���� ��