题目内容
5.在100℃时,将0.40mol二氧化氮气体充入 2L密闭容器中,每隔一段时间对该容器内的物质进行分析,得到如表数据,下列说法中正确的是( )| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 反应开始20 s内以二氧化氮表示的平均反应速率为0.00125 mol/L•s | |
| B. | 80 s时向容器中加入0.32 mol氦气,同时将容器扩大为 4 L,则平衡将不移动 | |
| C. | 当反应达到平衡后,若缩小容器的体积,平衡向生成N2O4方向移动,气体的颜色变深 | |
| D. | 若其它条件不变,起始投料改为0.40 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等 |
分析 由表中数据,60s、80s时四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.35,n2=0.07,n3=n4=0.24,
A.根据v=$\frac{\frac{△n}{V}}{△t}$计算反应开始20 s内以二氧化氮表示的平均反应速率;
B.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动;
C.相同条件下,0.4mol二氧化氮与0.2mol四氧化二氮互为等效平衡;
D.相同条件下,起始时向容器中充入0.20 mol N2O4,达到平衡与开始投入0.40molNO2到达的平衡状态是等效平衡.
解答 解:由表中数据,60s、80s时四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,
A.反应开始20 s内以二氧化氮表示的平均反应速率v(NO2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.4mol-0.3mol}{2L}}{20s}$=0.0025 mol/(L•s),故A错误;
B.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故B错误;
C.当反应达到平衡后,若缩小容器的体积,平衡向生成N2O4方向移动,但因为二氧化氮的浓度增大,混合气体颜色变深,故C正确;
D.相同条件下,起始投料为0.20 mol N2O4达到平衡与开始投入0.40molNO2到达的平衡状态相同,故D错误;
答选C.
点评 本题考查化学反应速率计算、化学平衡影响因素、等效平衡等知识,题目难度中等,B选项为易错点,注意总压强不变但反应混合气体的分压减小,相当于降低压强,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
13. 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
 如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )
如图所示,在U型管(惰性电极)装入含有紫色石蕊的Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒立的三色“彩虹”,从左到右颜色的次序是( )| A. | 紫、红、蓝 | B. | 红、蓝、紫 | C. | 红、紫、蓝 | D. | 蓝、紫、红 |
10.某核素${\;}_{Z}^{A}$X可形成HmX型氢化物,则 a g HmX 含有( )
| A. | $\frac{a}{A+m}$(A-Z+m)mol中子 | B. | $\frac{a}{A}$(Z+m)mol电子 | ||
| C. | $\frac{a}{A+m}$(Z+m)mol质子 | D. | $\frac{a}{A}$mmol HmX |
17.下列描述中不正确的是( )
| A. | CS2为直线形的非极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
15.某元素的一个原子核内质子数为m,中子数为n,则下列说法正确的是( )
| A. | 该元素的相对原子质量的近似值一定是(m+n) | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若12C的质量为Wg,则该原子的质量约为(m+n)Wg | |
| D. | 若NA表示阿伏加德罗常数,则该原子的摩尔质量为(m+n)•NA |
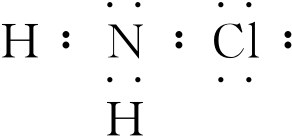 ,H2NCl中氯的化合价为+1价.
,H2NCl中氯的化合价为+1价.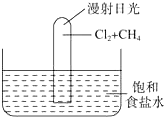 如图所示实验,试推测可能观察到的现象是:
如图所示实验,试推测可能观察到的现象是: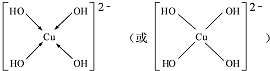 .(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.
.(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.