题目内容
16.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 由D和18O所组成的水11g,所含中子数为4NA | |
| B. | 1 L 0.4 mol•L-1稀硝酸与Fe完全反应,转移电子数为0.3NA | |
| C. | 标准状况下,2.24LCHCl3所含分子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
分析 A.D和18O所组成的水的摩尔质量为22g/mol,该水分子中含有12个中子,11g该水的物质的量为0.5mol,含有5.5mol中子;
B.1 L 0.4 mol•L-1稀硝酸与Fe完全反应,生成硝酸铁或硝酸亚铁、一氧化氮和水,依据电子守恒计算分析;
C.标准状况下,三氯甲烷不是气体,气体摩尔体积的应用条件是标准状况下为22.4L/mol;
D、NO和氧气反应生成NO2后,NO2存在平衡:2NO2?N2O4.
解答 解:A.11g由D和18O所组成的水物质的量为:$\frac{11g}{22g/mol}$=0.5mol,0.5mol该水中含有6mol中子,所含的中子数为6NA,故A错误;
B.1 L 0.4 mol•L-1稀硝酸与Fe完全反应,生成硝酸铁、一氧化氮和水,其中做酸的硝酸为0.3mol,做氧化剂的硝酸为0.1mol,HNO3~NO~3e-,转移电子数为0.3NA ,若生成硝酸亚铁3Fe~8HNO3~6e-,则电子转移0.3e-,故B正确;
C.标准状况下,三氯甲烷不是气体,2.24LCHCl3的物质的量不是0.1mol,则含分子数不一定为0.1NA,故C错误;
D.2molNO与1molO2充分反应生成2molNO2后,NO2存在平衡:2NO2?N2O4,导致分子个数小于2NA个,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
相关题目
11.我国科学家屠呦呦因在青蒿素发现和治疗中的贡献,获得了诺贝尔生理学或医学奖,青蒿素是一种治疗疟疾的特效药.由植物黄花蒿叶中提取的青蒿素还可合成用于抗氯喹恶性疟及凶险型疟疾的蒿甲醚,其合成路线如下:
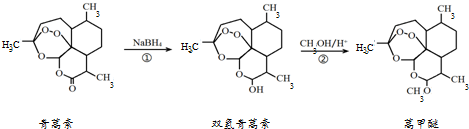
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 青蒿素的分子式是C15H21O5 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 青蒿素分子内的“-O-O-”基团可能对疟原虫有抑制作用 |
1.下列说法正确的是( )
| A. | 化学变化一定会产生新的核素 | |
| B. | 明矾净水过程涉及化学变化 | |
| C. | 催化剂能改变化学反应的活化能和焓变 | |
| D. | 在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径: 途径a:Fe$\stackrel{H_{2}SO_{4}}{→}$H2$→_{△}^{Cu}$Cu 途径b:CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu 实际操作中,制得等质量的铜时,途径a和途径b消耗Fe的质量一定相等 |
8.下列电解质溶液中,微粒的物质的量浓度关系一定正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 25℃时,0.1 mol•L-1CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,浓度均为0.1 mol•L-1的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
5.下列离子方程式正确的是( )
| A. | 高锰酸钾溶液与乙二酸(草酸)反应:2MnO4-+5C2O42-+16H+→2Mn2++10CO2↑+8H2O | |
| B. | 苯酚与碳酸钠溶液: +CO32-→ +CO32-→ +H2CO3 +H2CO3 | |
| C. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
6.下列物质属于纯净物的是( )
| A. | 汽油 | B. | 红酒 | C. | 干冰 | D. | 碘酒 |
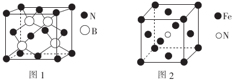
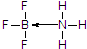 (标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN.
(标注出其中的配位键);利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图1为该晶体的晶胞结构,该功能陶瓷晶体的化学式为BN. (1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.
(1)目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1.