题目内容
11.现有A、B、C、D、E五种常见短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和.
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6 H2O.
(3)用电子式表示化合物D2C的形成过程:
 .
.(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:O2+4e-+2H2O=4OH-;负极反应:2CO-4e-+8OH-=2CO32-+4H2O.
分析 A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;A、D同主族,A是所有元素中原子半径最小的元素,则A为氢元素,则D为钠元素;C元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为氧元素;B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,应是氢氧化铝与强酸、强碱之间的反应,且B与C的位置相邻,则B为氮元素、E为Al,甲为HNO3,乙为NaOH,丙为Al(OH)3;B、E两种元素原子最外层电子数之和为20,A、C、D三种元素原子最外层电子数之和为20,通过验证符合题意,据此进行答题.
解答 解:A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;A、D同主族,A是所有元素中原子半径最小的元素,则A为氢元素,则D为钠元素;C元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为氧元素;B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素,应是氢氧化铝与强酸、强碱之间的反应,且B与C的位置相邻,则B为氮元素、E为Al,甲为HNO3,乙为NaOH,丙为Al(OH)3;B、E两种元素原子最外层电子数之和为20,A、C、D三种元素原子最外层电子数之和为20,符合题意,
(1)乙+丙在溶液中反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)化合物NH3与NO在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,应生成氮气与水,其反应的化学方程式为:4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6 H2O,
故答案为:4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O;
(3)D2C为Na2O,氧化钠为离子化合物,用电子式表示化合物Na2O的形成过程为: ,
,
故答案为: ;
;
(4)碳元素与元素C(原子物质的量之比1:1)形成的化合物为CO,某原电池中,电解质为KOH溶液,分别向负极通入CO,向正极通入O2,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,负极发生还原反应,负极反应式为:2CO-4e-+8OH-=2CO32-+4H2O,
故答案为:O2+4e-+2H2O=4OH-;2CO-4e-+8OH-=2CO32-+4H2O.
点评 本题考查位置结构性质关系应用,题目难度中等,试题侧重对化学用语的考查,推断元素好似解题关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案| A. | CO2 | B. | Na2O | C. | Na2O2 | D. | FeSO4 |
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式
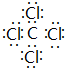 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.