题目内容
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 10 g 46%的乙醇水溶液中所含氢原子数目为1.2NA | |
| B. | 标准状况下,2.24 L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| C. | 高温下,0.2 mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA | |
| D. | 25℃时,100 mL pH=13的Ba(OH)2溶液中OH-的数目为0.02NA |
分析 A.乙醇溶液中乙醇、水分子都含有氢原子;
B.氯气与水反应为可逆反应,不能进行到底;
C.依据方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2计算;
D.100 mL pH=13的Ba(OH)2溶液中OH-的浓度是0.1 mol•L-1,依据n=CV计算氢氧根离子数目.
解答 解:A.12.10 g 46%的乙醇水溶液中含有C2H5OH 0.1 mol、H2O 0.3 mol,二者含有的氢原子数目的总和是1.2NA,故A正确;
B.氯气溶于水时只有少量Cl2与水发生反应Cl2+H2O?HCl+HClO,所以2.24 L氯气转移的电子数目小于0.1NA,故B错误;
C.高温下,铁与水蒸气发生下列反应:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,0.2 mol铁参加反应生成氢气的分子数目应为$\frac{0.8}{3}$NA,故C错误;
D.100 mL pH=13的Ba(OH)2溶液中OH-的浓度是0.1 mol•L-1,其中含有的OH-数目为0.01NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意氯气与水反应为可逆反应,选项BD为易错选项.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
15.下列物质属于电解质的是( )
| A. | 铝单质 | B. | 酒精 | C. | 硝酸钾 | D. | 二氧化碳 |
13.下列四组物质中,两种分子不具有相同核外电子总数的是( )
| A. | H2O2和HCl | B. | CO和NO | C. | H2O和CH4 | D. | H2S和F2 |
10.下列有关化学用语使用正确的是( )
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| B. | 次氯酸分子的电子式: | |
| C. | 乙酸乙酯的结构简式: | |
| D. | Al(OH)3的电离:H++AlO2-+H2O?Al(OH)2?Al3++3OH- |
3. 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
 已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )
已知:常温下,(1)Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11;(2)H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如图所示,下列叙述错误的是( )| A. | 在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在$\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})}$=10-3 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
 .
.
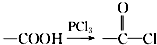 ,请回答以下问题:
,请回答以下问题: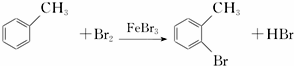 .
.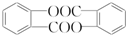 .
.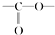 结构
结构 ,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.
,工业上丙可用于氯气管道的泄露,涉及的化学方程式为8NH3+3Cl2=6NH4Cl+N2.