题目内容
将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为:CH4+10OH--8e-=CO32-+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-=8OH-,下列叙述正确的是( )
| A、通入甲烷的电极为正极 |
| B、燃料电池工作时,溶液中的OH-离子向正极移动 |
| C、正极发生氧化反应 |
| D、该电池使用一段时间后应补充氢氧化钾 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:燃料电池中,失电子发生氧化反应的电极为负极、得电子发生还原反应的电极为正极,负极反应式为CH4+10OH--8e-=CO32-+7H2O、正极反应式是2O2+4H2O+8e-=8OH-,放电时,阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答:
解:A.通入甲烷的电极失电子发生氧化反应,所以该电极是负极,故A错误;
B.放电时,溶液中的氢氧根离子向负极移动,故B错误;
C.正极上得电子发生还原反应,故C错误;
D.其电池反应式为CH4+2OH-+2O2=CO32-+3H2O,放电时KOH参加反应,所以该电池使用一段时间后应补充氢氧化钾,故D正确;
故选D.
B.放电时,溶液中的氢氧根离子向负极移动,故B错误;
C.正极上得电子发生还原反应,故C错误;
D.其电池反应式为CH4+2OH-+2O2=CO32-+3H2O,放电时KOH参加反应,所以该电池使用一段时间后应补充氢氧化钾,故D正确;
故选D.
点评:本题考查了化学电源新型电池,明确物质得失电子与电极的关系是解本题关键,知道阴阳离子移动方向,题目难度不大.

练习册系列答案
相关题目
25℃时,有pH=3的盐酸和醋酸溶液,下列说法正确的是( )
| A、两种溶液中由水电离出来的c(H+)不相同 |
| B、中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| C、将两溶液等体积混合,c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
| D、分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n |
下列化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、氯化钠的电子式: |
| C、明矾的化学式:KAlSO4?12H2O |
| D、淀粉的分子式:(C6H10O5)n |
氰气的分子式为(CN)2,其性质和卤素相似,称为“类卤素”.以下关于(CN)2的叙述中不正确的是
( )
( )
| A、(CN)2化学性质活泼 |
| B、(CN)2不能和NaOH反应 |
| C、(CN)2参加反应时常做氧化剂 |
| D、(CN)2可以和H2反应 |
下列各组物质中,互为“同系物”的是( )
| A、CH3-O-CH3和CH3-CH2-OH |
| B、CH4 和CH3CH3 |
| C、O2 和O3 |
D、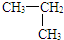 和 CH3-CH2-CH3 和 CH3-CH2-CH3 |
下列物质中,属于纯净物的是( )
| A、天然气 | B、水煤气 |
| C、裂解气 | D、丙烷 |
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、得电子能力随核电荷数的增加而增强 |
| B、单质的氧化性随核电荷数的增加而逐渐减弱 |
| C、单质的颜色随核电荷数的增加而加深 |
| D、它们的氢化物的稳定性随核电荷数的增加而减弱 |
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述正确的是( )
| A、该溶液的pH=3 |
| B、升高温度,溶液的pH增大 |
| C、此酸的电离平衡常数约为1×10-6 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |