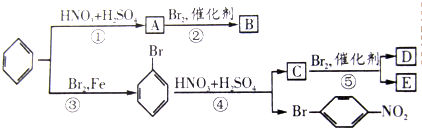
题目内容
常温下,1mol/L醋酸100mL和0.1mol/L氢氧化钠50mL混合,判断混合溶液中离子浓度大小顺序.
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:醋酸的物质的量n=CV=1mol/L×0.1L=0.1mol,氢氧化钠的物质的量n=CV=0.1mol/L×0.05L=0.005mol,两者混合后,醋酸大量过量,得0.095molCH3COOH和0.005molCH3COONa的混合溶液,溶液中以CH3COOH为主,据此分析.
解答:
解:醋酸的物质的量n=CV=1mol/L×0.1L=0.1mol,氢氧化钠的物质的量n=CV=0.1mol/L×0.05L=0.005mol,两者混合后,醋酸大量过量,得0.095molCH3COOH和0.005molCH3COONa的混合溶液,溶液中以CH3COOH为主.
CH3COOH在溶液中的行为:CH3COOH?CH3COO-+H+,电离出的CH3COO-和H+的物质的量相同,而且由于溶液中以CH3COOH为主,故溶液中CH3COO-和H+的物质的量浓度均大于Na+和OH-的浓度;
CH3COONa在溶液中又能电离出CH3COO-,故可知:C(CH3COO-)>C(H+);
根据电荷守恒可知:C(CH3COO-)+C(OH-)=C(H+)+C(Na+),而C(CH3COO-)>C(H+),故可知:C(Na+)>C(OH-),故溶液中的离子浓度的关系为:C(CH3COO-)>C(H+)>C(Na+)>C(OH-);
答:所得混合溶液中离子浓度大小顺序为:C(CH3COO-)>C(H+)>C(Na+)>C(OH-).
CH3COOH在溶液中的行为:CH3COOH?CH3COO-+H+,电离出的CH3COO-和H+的物质的量相同,而且由于溶液中以CH3COOH为主,故溶液中CH3COO-和H+的物质的量浓度均大于Na+和OH-的浓度;
CH3COONa在溶液中又能电离出CH3COO-,故可知:C(CH3COO-)>C(H+);
根据电荷守恒可知:C(CH3COO-)+C(OH-)=C(H+)+C(Na+),而C(CH3COO-)>C(H+),故可知:C(Na+)>C(OH-),故溶液中的离子浓度的关系为:C(CH3COO-)>C(H+)>C(Na+)>C(OH-);
答:所得混合溶液中离子浓度大小顺序为:C(CH3COO-)>C(H+)>C(Na+)>C(OH-).
点评:本题考查了混合弱酸和强碱混合溶液中的离子浓度的大小比较,应注意的是先考虑酸碱中和反应,根据反应情况判断出所得混合溶液的溶质,再分析离子浓度的大小关系.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列关于水的说法正确的是( )
| A、我们平时应多饮用很纯净的水,防止有毒物质进入体内 | ||
| B、所有天然水都不能饮用 | ||
C、人体内含有约
| ||
| D、人体需要不断补充水分,每人每天需要补充2.5~4L水 |
在下列各说法中,正确的是( )
| A、△H<0表示放热反应,△H>0表示吸热反应 |
| B、1molH2SO4与1molBa(OH)2反应放出的热叫中和热 |
| C、1molH2与0.5molO2反应放出的热就是H2的燃烧热 |
| D、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
下列说法正确的是( )
| A、摩尔是一个基本物理量 |
| B、CH4的摩尔质量为16g |
| C、在同温同压下,相同体积的任何气体单质所含分子数相同 |
| D、500mL,1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
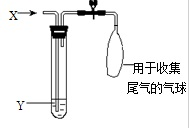 如图是检验气体性质的一种实验装置,请回答:
如图是检验气体性质的一种实验装置,请回答:

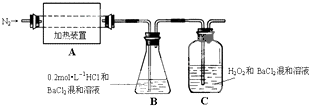 硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2?6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题: