题目内容
8.已知Ca(OH)2、CaCO3、Ca(HCO3)2都是电解质,根据测定溶液的导电能力的实验装置图,将实验现象填在下表空格中| 实验操作 | 灯泡亮度变化 |
| 通入CO2以前 | 亮 |
| 开始通入CO2时 | 亮变暗 |
| 恰好完全沉淀 | 至全暗 |
| 沉淀完全后,继续通入过量的CO2 | 暗变亮 |
| 再通入CO2 | 不变 |

分析 溶液能导电是因为溶液中的溶质发生电离,存在自由移动的阴阳离子,然后根据化学反应方程式判断溶液中溶质浓度的变化,浓度的大小决定导电能力的大小
解答 解:由题意知,氢氧化钙能电离出自由移动的钙离子和氢氧根离子,故没氧化碳以前,灯泡是亮的;
随着不断通入CO2发生的化学反应为:Ca(OH)2+CO2=CaCO3↓+H2O ①,CaCO3+H2O+CO2=Ca(HCO3)2 ②
当CO2不足量或恰好反应时,发生的反应是①,碳酸钙是沉淀,水是弱电解质,导致溶液中离子浓度逐渐减小,导电能力逐渐减弱,所以灯泡由亮变暗至全暗;
当继续通入二氧化碳时发生的反应是②,生成的碳酸氢钙是强电解质,易溶于水,电离出自由移动的离子,溶液中离子浓度逐渐增大,导电能力逐渐增强,所以灯泡又由暗变亮;
当溶液饱和,离子浓度最大,导电能力最强,继续通入二氧化碳对导电能力无影响,所以灯泡的亮度保持不变.
故答案为:
| 实验操作 | 灯泡亮度变化 |
| 通入CO2以前 | 亮 |
| 开始通入CO2时 | 亮变暗 |
| 恰好完全沉淀 | 至全暗 |
| 沉淀完全后,继续通入过量的CO2 | 暗变亮 |
| 再通入CO2 | 不变 |
点评 本题考查了溶液导电性强弱的分析判断,对于图象分析题,分析时注意:1、图象中曲线的趋向;2、曲线的拐点,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
19.下列反应的离子方程式中正确的是( )
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| B. | 小苏打溶液中加入少量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| C. | 往Ca(ClO)2溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ | |
| D. | 碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O |
13.下列说法不正确的是( )
①凡是易溶于水的化合物都可以写成离子形式
②凡是强电解质,在离子方程式中都要以离子形式表示
③复分解反应中,离子反应总是向着溶液中反应物离子浓度减少的方向进行,任何一种离子的浓度在离子反应中一定变小
④单质和氧化物在离子方程式中不能用离子符号表示
⑤凡是酸都可以在离子方程式中用H+表示
⑥参加离子反应的物质一定都是电解质.
①凡是易溶于水的化合物都可以写成离子形式
②凡是强电解质,在离子方程式中都要以离子形式表示
③复分解反应中,离子反应总是向着溶液中反应物离子浓度减少的方向进行,任何一种离子的浓度在离子反应中一定变小
④单质和氧化物在离子方程式中不能用离子符号表示
⑤凡是酸都可以在离子方程式中用H+表示
⑥参加离子反应的物质一定都是电解质.
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤⑥ | D. | ①②③⑤⑥ |
20.熔点最低的金属洒落地上,用来处理的物质是( )
| A. | O2 | B. | S | C. | Cl2 | D. | I2 |
16.关于水的离子积常数,下列说法不正确的是( )
| A. | 100℃水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水中,25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | 25℃时,任何以水为溶剂的稀溶液中c(H+)•c(OH-)=1×10-14 | |
| D. | KW值随温度升高而增大 |

 .
. 二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
 双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题:
双草酸酯(CPPO)是冷光源发光制料的主要成分,结构简式如图所示.请回答下列问题: +4NaOH→2
+4NaOH→2 +NaOOCCOONa+2CH3CH2OH;
+NaOOCCOONa+2CH3CH2OH; ,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式
,CPPO可由芳香族化合物A和脂肪族化合物B在一定条件下合成,A的结构简式 ,写出合成CPPO的化学方程式ClOC-COCl+2
,写出合成CPPO的化学方程式ClOC-COCl+2 与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n
与脂肪族化合物B可聚合成性能良好,有使用价值的树脂,写出该聚合反应的方程式n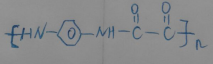 +2nHCl.
+2nHCl.