题目内容
关于碱金属单质的性质叙述错误的是( )
| A、在空气中燃烧的生成物都是过氧化物 |
| B、与盐溶液反应时都能生成碱和氢气 |
| C、熔沸点随原子序数增加而降低 |
| D、还原性随原子电子层数的增加而增加 |
考点:碱金属的性质
专题:元素周期律与元素周期表专题
分析:A.锂在空气中燃烧生成氧化锂,钾燃烧生成超氧化钾;
B.碱金属性质活泼,与盐溶液中的水反应生成碱和氢气;
C.金属晶体原子半径越大熔沸点越低;
D.碱金属原子半径越大,失去电子的能力越强,金属性越强,单质还原性越强.
B.碱金属性质活泼,与盐溶液中的水反应生成碱和氢气;
C.金属晶体原子半径越大熔沸点越低;
D.碱金属原子半径越大,失去电子的能力越强,金属性越强,单质还原性越强.
解答:
解:A.锂在空气中燃烧生成氧化锂,钾燃烧生成超氧化钾,故A错误;
B.碱金属性质活泼,与盐溶液中的水反应生成碱和氢气,故B正确;
C.碱金属随原子序数增加,原子半径增大,金属键越弱,熔沸点越低,故C正确;
D.碱金属随原子序数增加,电子层数的增加,失去电子的能力越强,金属性越强,单质还原性越强,故D正确;
故选:A.
B.碱金属性质活泼,与盐溶液中的水反应生成碱和氢气,故B正确;
C.碱金属随原子序数增加,原子半径增大,金属键越弱,熔沸点越低,故C正确;
D.碱金属随原子序数增加,电子层数的增加,失去电子的能力越强,金属性越强,单质还原性越强,故D正确;
故选:A.
点评:本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题的关键,题目难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
 丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )
丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )| A、丹参素的分子式为C9H10O5 |
| B、丹参素能发生缩聚、消去、氧化反应 |
| C、1 mol丹参素最多可以和3mol H2发生加成反应 |
| D、1 mol丹参素与足量Na2CO3发生反应最多可生成二氧化碳1.5mol |
下列分子中含有两个π键的是( )
| A、O2 |
| B、N2 |
| C、H2O |
| D、C2H4 |
下列叙述错误的是( )
| A、NaHCO3溶液中:c(H+)+c(H2CO3)═(CO32-)+c(OH-) |
| B、25℃时,0.2mol?L-1盐酸与等体积0.05mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| C、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| D、25℃时,若0.3mol?L-1 HY溶液与0.3mol?L-1 NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9mol?L-1 |
下列反应的离子方程式书写正确的是( )
| A、铁片放入稀盐酸中:Fe+2H+=Fe3++H2↑ |
| B、氢氧化铜与稀硫酸:OH-+H+=H2O |
| C、氯化钡溶液与硝酸银溶液:Cl-+Ag+=AgCl↓ |
| D、碳酸钙与稀硝酸:CO32-+2H+=CO2↑+H2O |
80年代,科学家研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60.下列说法正确的是
( )
( )
| A、C60是一种新型的化合物 |
| B、C60含有离子键 |
| C、C60的摩尔质量为720 |
| D、C60中的化学键只有共价键 |
下列对各组元素性质递变情况描述错误的是( )
| A、Li、Be、B原子最外层电子数依次增多 |
| B、P、S、Cl元素最高正价依次升高 |
| C、N、O、F元素最高正价依次升高 |
| D、Na、K、Rb的最外层电子数相同 |
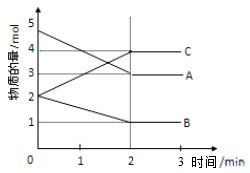 某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
某温度时,在一恒容密闭容器中,A、B、C三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示,从图中的数据分析:
