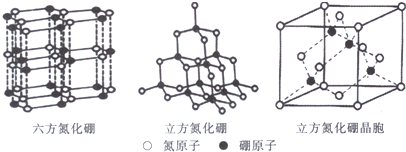
题目内容
9.明末清初著名的科学家宋应星在其《天工开物》某条目下写道:“凡石灰经火焚炼为用.…百里内外,土中必生可燔石,石以青色为上,黄白次之.石必掩土内二三尺,掘取受燔,土面见风者不用.”其中的“可燔石”是指( )| A. | 黏土 | B. | 纯碱 | C. | 石灰石 | D. | 熟石灰 |
分析 根据宋应星在其《天工开物》中的描述可知,可燔石是在自然界中存在的矿物质,将其加热后的产物有较广泛的用途,据此分析.
解答 解:根据宋应星在其《天工开物》中的描述可知,可燔石是在自然界中存在的矿物质,故BD排除;将其加热后所得的产物有较广泛的用途,由于石灰石加热后能制得生石灰,故可燔石为石灰石,故选C.
点评 本题结合文言文考查了物质的存在和转化,难度不大,注意能在自然界存在的物质必定是稳定性较好的物质.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
19.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5 mol•L-1 亚硫酸溶液中含有的H+数为2NA | |
| C. | 分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA | |
| D. | 1mol FeI2与足量氯气反应时转移的电子数为2NA |
20.下列反应的离子方程式中,正确的是( )
| A. | 向硝酸银溶液中加盐酸:Ag++Cl-═AgCl↓ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+H+═Mg2++H2O+CO2↑ |
17.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
14.化学与日常生活紧密相关,下列说法错误的是( )
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| D. | 碳酸氢钠可用来治疗胃酸过多 |
18.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
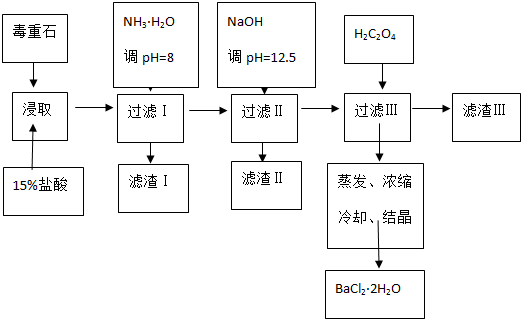
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
加入NH3•H2O调节pH=8可除去Fe3+;(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)已知:
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.610-7,Ksp(CaC2O4)=2.310-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H20 Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
试回答:滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
19.在下列各溶液中,一定可以大量共存的离子组是( )
| A. | 室温下,pH=1的溶液中:K+、Fe2+、ClO-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Cu2+、Na+、SO42-、NO3- | |
| C. | 加入铝粉产生大量氢气的溶液中:Na+、NH4+、NO3-、SO42- | |
| D. | 在0.1 mol•L-1 Fe3+溶液中:K+、Na+、HCO3-、SO42- |