题目内容
9.设用 N A表示阿伏加德罗常数的值,则下列说法错误的是( )| A. | 32gO2所含有的原子数目为NA | |
| B. | 0.5mol CO2含有的原子数目为1.5 NA | |
| C. | 1mol H2O含有的水分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5 mol |
分析 A、氧气由氧原子构成;
B、二氧化碳为三原子分子;
C、分子个数N=nNA;
D、物质的量n=$\frac{N}{{N}_{A}}$.
解答 解:A、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量为2mol,个数为2NA个,故A错误;
B、二氧化碳为三原子分子,故0.5mol二氧化碳中含1.5mol原子,个数为1.5NA个,故B正确;
C、1mol水中的分子个数N=nNA=1mol×NA/mol=NA个,故C正确;
D、0.5NA个氧气分子的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}/mol}$=0.5mol,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列物质燃烧时,不会造成大气污染的是( )
| A. | 石油 | B. | 农作物秸秆 | C. | 煤 | D. | 氢气 |
1.今年地球日主题为:“珍惜地球资源 转变发展方式 倡导低碳生活”.旨在借助地球日活动平台提高公众对国土资源国情的认识,普及有关科学技术知识,引导全社会积极参与节约集约利用资源、减少碳排放、促进经济发展.下列做法不符合“低碳经济”要求的是( )
| A. | 大力发展以煤炭为原料的火力发电,促进经济发展 | |
| B. | 在生产和生活中提倡使用节能技术和节能用具 | |
| C. | 开发新能源,代替传统能源 | |
| D. | 提倡乘坐公交车、骑自行车或步行的方式出行 |


 .
. .
. .
. 的合成路线,合成路线流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线,合成路线流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH. .
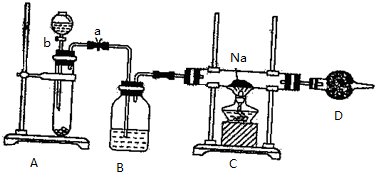
. 实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答:
实验室用如图所示装置制取溴化亚铁.D和d中均盛有液溴,E为外套电炉丝的瓷管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将干燥、纯净的CO2气流通入D中,然后将铁粉加热至600℃~700℃,E管中反应开始.E中的反应为:2Fe+3Br2═2FeBr3,2FeBr3$\frac{\underline{\;\;△\;\;}}{\;}$2FeBr2+Br2↑,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.请回答: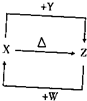
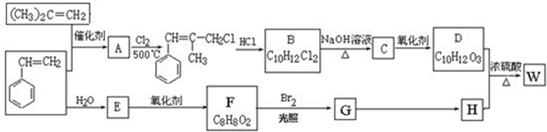

 ;W的结构简式:
;W的结构简式: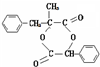 .
.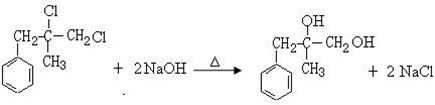 ;由D生成高分子化合物的方程式
;由D生成高分子化合物的方程式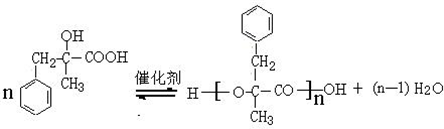 .
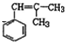
.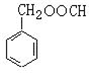 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1.