题目内容
15.已知元素X位于Y的下一周期,X、Y的原子序数均不大于20.某含氧酸盐甲的化学式为XYO3.请回答: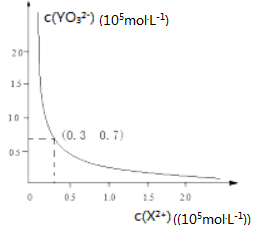
(1)常温下X的单质能与水发生反应,则X位于周期表第四周期第ⅠA族,X、Y形成简单离子半径大小关系为X小于Y(填“大于”、“小于”或“等于”).395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是4KClO3$\frac{\underline{\;395℃\;}}{\;}$3KClO4+KCl.
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为CaSO3(填化学式).该气体能使高锰酸钾溶液褪色,该反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
②25℃时,甲在水中的沉淀溶解平衡曲线如图所示,若要使溶液X2+离子沉淀完全,则加入YO32-离子的最小浓度为2.1×10-7mol•L-1.
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙中所含化学键类型极性共价键.
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
分析 (1)含氧酸盐甲的化学式为XYO3,则X为金属,Y为非金属,X、Y的原子序数均不大于20,X的单质能与水发生反应,元素X为K,X位于Y的下一周期,则元素Y为Cl;
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则该气体为SO2,此反应为复分解反应,则反应前后元素价态不变,则甲中含S元素且为+4价,根据化合价代数和为0,则XSO3中元素X+2价,且甲难溶于水,则元素X为Ca,甲为CaSO3;
(3)甲能与盐酸反应,生成无色、无味的气体乙,且甲在水中持续加热生成一种更难溶的物质并逸出气体乙,则甲为MgCO3,乙为CO2,以此来解答.
解答 解:(1)含氧酸盐甲的化学式为XYO3,则X为金属,Y为非金属,X、Y的原子序数均不大于20,X的单质能与水发生反应,故元素X为K,X位于Y的下一周期,则元素Y为Cl,元素X为K,K核外电子数为19,有4个电子层,最外层有1个电子,位于周期表中第四周期第ⅠA族;X、Y形成简单离子,其核外电子排布相同,则核大径小,X核电荷数19,Y核电荷数17,故X小于Y;则含氧酸盐甲的化学式为KClO3,KClO3能发生分解反应生成两种盐,一种是含Cl元素的无氧酸盐,由电子、原子守恒可知该反应的化学方程式是4KClO3$\frac{\underline{\;395℃\;}}{\;}$3KClO4+KCl,
故答案为:第四周期第ⅠA族;小于;4KClO3$\frac{\underline{\;395℃\;}}{\;}$3KClO4+KCl;
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则该气体为SO2,此反应为复分解反应,则反应前后元素价态不变,则甲中含S元素且为+4价,根据化合价代数和为0,则XSO3中元素X+2价,且甲难溶于水,则元素X为Ca,甲为CaSO3,
①由以上分析得,甲为CaSO3;SO2和高锰酸钾发生氧化还原反应,对应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:CaSO3;5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
②25℃时,由甲在水中的沉淀溶解平衡曲线图可知Ksp=0.3×10-5mol/L×0.7×10-5mol/L=2.1×10-11mol/L,若要使溶液X2+离子沉淀完全,则加入YO32-离子的最小浓度为$\frac{2.1×1{0}^{-11}}{1×1{0}^{-5}}$=2.1×10-7mol/L,
故答案为:2.1×10-7;
(3)甲能与盐酸反应,生成无色、无味的气体乙,且甲在水中持续加热生成一种更难溶的物质并逸出气体乙,则甲为MgCO3,乙为CO2,
①乙中所含化学键类型为极性共价键,故答案为:极性共价键;
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑,
故答案为:MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
点评 本题考查原子结构与元素周期律,为高频考点,把握短周期元素的性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

| A. | 3种 | B. | 4种 | C. | 6种 | D. | 12种 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
实验Ⅰ:

(1)无色气体为NH3.
(2)该固体混合物的成分为NH4I、MgBr2、AlCl3.
实验Ⅱ:取一定量的该固体混合物溶于水配成1L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示.
| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
(4)原固体混合物中各组成成分的物质的量之比为.

 .B的离子结构示意图:
.B的离子结构示意图: .D在周期表的位置:第3周期第ⅦA.写出C的原子符号2412Mg.
.D在周期表的位置:第3周期第ⅦA.写出C的原子符号2412Mg. .
.
 .
.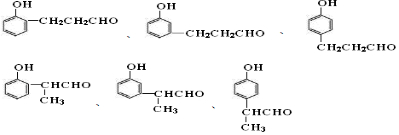 中的任意一种.
中的任意一种.