题目内容
16.硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一.如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
(1)要将洗出液中的溶质析出,采用的方法是蒸发(填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有蒸发皿、酒精灯、带铁圈的铁架台.
(2)上流程中加入NaOH溶液,反应的离子方程式为SiO2+2OH-=SiO32-+H2O.
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.请在方程式中用“单线桥”标出电子转移方向和数目
 .
.
分析 向海边的石英砂(含氯化钠、氧化铁等杂质)中加入水,NaCl溶于水,Fe2O3、SiO2不溶于水,然后过滤,将难溶物研磨,然后加入NaOH溶液,SiO2属于酸性氧化物,能溶解SiO2生成Na2SiO3,Fe2O3不溶于NaOH溶液,过滤得到的残渣为Fe2O3,将滤液蒸发浓缩、冷却结晶,过滤后得到硅酸钠晶体,滤液中含有部分硅酸钠和NaOH,
(1)NaCl能溶于水,从NaCl溶液中得到NaCl晶体,可以采用蒸发结晶的方法;根据仪器用途选取合适的仪器;
(2)NaOH能和SiO2反应生成Na2SiO3和水;
(3)该反应中Fe元素化合价由+3价变为0价、Al元素化合价由0价变为+3价,转移电子数为6.
解答 解:向海边的石英砂(含氯化钠、氧化铁等杂质)中加入水,NaCl溶于水,Fe2O3、SiO2不溶于水,然后过滤,将难溶物研磨,然后加入NaOH溶液,SiO2属于酸性氧化物,能溶解SiO2生成Na2SiO3,Fe2O3不溶于NaOH溶液,过滤得到的残渣为Fe2O3,将滤液蒸发浓缩、冷却结晶,过滤后得到硅酸钠晶体,滤液中含有部分硅酸钠和NaOH,
(1)NaCl能溶于水,从NaCl溶液中得到NaCl晶体,可以采用蒸发结晶的方法;蒸发时使用的仪器有盛放液体的蒸发皿、用于加热的仪器酒精灯、盛放蒸发皿的带铁圈的铁架台,
故答案为:蒸发;蒸发皿、酒精灯、带铁圈的铁架台;
(2)NaOH能和SiO2反应生成Na2SiO3和水,离子反应方程式为SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)该反应中Fe元素化合价由+3价变为0价、Al元素化合价由0价变为+3价,转移电子数为6,
电子转移方向和数目为 ,故答案为:
,故答案为: .
.
点评 本题考查物质分离和提纯,为高频考点,涉及基本操作、氧化还原反应、离子方程式书写、仪器的选取等知识点,明确基本操作方法、物质之间的反应是解本题关键,难点是电子转移方向和数目的表示方法.

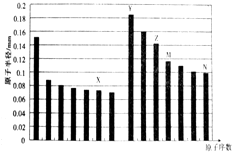
| A. | Y、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | M的氧化物既能碱反应又能和氢氟酸反应,但是该氧化物是典型的酸性氧化物 | |
| D. | 工业上常用的电解Y和N形成的化合物的水溶液制取Y的单质 |
| A. | [Co(NH3)4Cl3]Cl | B. | [Co(NH3)3Cl3] | C. | [Co(NH3)6]Cl3 | D. | [Co(NH3)5Cl]Cl3 |
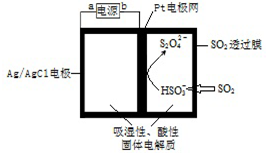
| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
| A. | 氯碱工业中NaOH的溶液在阳极区产生 | |
| B. | 电解精炼铜时,阳极质量的减小等于阴极质量的增加 | |
| C. | 铁制品表面镀镍时,镀件做阳极 | |
| D. | 电解法制铝的过程中需不断补充阳极材料(石墨电极) |
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
| A. | A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间内消耗a molA,同时生成2a mol C | |
| C. | A的浓度不再变化 | |
| D. | 混合气体总物质的量为2a mol |