题目内容
7.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )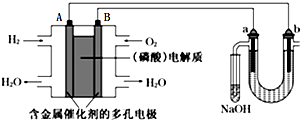
| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:A极→外电路→b极→溶液→a极→B极 | |
| C. | NaOH溶液充分吸收后所得溶液可制作漂白水 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,a极周围也会产生2.24L(标准状况)气体 |
分析 A、氢氧燃料电池中,正极上放电的是氧气;
B、电子在导线中移动,不能在溶液中移动;
C、还原性:Br->Cl-,还原性强的离子在阳极先放电,氢氧化钠溶液吸收电解时产生的气体;
D、燃料电池和电解池中转移的电子数是相等的.
解答 解:A、氢氧燃料电池中,正极上放电的是氧气,在酸性电解质环境下,电极反应式为:O2+4H++4e-═2H2O,故A错误;
B、电子在导线中移动,不能在溶液中移动,故B错误;
C、还原性强的离子在阳极先放电,电解时,a电极周围首先放电的是Br-后放电的为Cl-,所以试管中NaOH溶液是用来吸收电解时产生的溴蒸气和氯气,生成的溶液都具有强氧化性,具有漂白性,故C正确;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗2.24L(标准状况)H2,根据电极反应:H2→2H++2e-,所以转移电子$\frac{2.24L}{22.4L/mol}$×2=0.02mol,a极的电极反应为:2Br--2e-→Br2,转移电子0.02mol,会产生0.01molBr2,Br2标准状况下为液态,故D错误.
故选C.
点评 本题考查学生原电池和电解池的工作原理,要求学生熟记教材知识,学以致用.

练习册系列答案
相关题目
17. 为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
 为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )| A. | a、c两点气体的平均相对分子质量:a>c | |
| B. | a、c两点气体的颜色:a浅,c深 | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
15.如表实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br与NaOH溶液是否发生反应 | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液,加AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 将打磨过的Al片投到一定浓度的CuCl2溶液,出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 | Al与CuCl2溶液反应,有H2和Cu(OH)2生成 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验乙醇与浓硫酸共热是否产生乙烯 | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
12.下列检验试剂选用正确的是( )
| A. | 用氯水、KSCN溶液检验FeCl3溶液中是否有FeCl2 | |
| B. | 用酸性高锰酸钾溶液检验FeCl3溶液中是否有FeCl2 | |
| C. | 用NaOH溶液检验MgCl2溶液中是否有FeCl2 | |
| D. | 用硝酸检验某黄色固体是黄铜还是纯铜 |
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是(Cu-64 O-16)( )
| A. | 1molNa2O2晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数为0.1NA | |
| C. | 32gO2和32g O3的所含的氧原子数都是为2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
 ,
,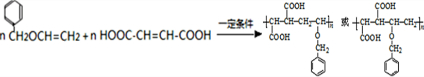 高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).