题目内容
17.请写出下列反应的化学方程式:(1)乙醇的催化氧化:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O.
(2)电解饱和食盐水:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(3)纤维素(C6H10O5)n燃烧:(C6H10O5)n+6nO2$\stackrel{点燃}{→}$6nCO2+5nH2O.
(4)乙酸和乙醇酯化:CH3COOH+C2H5OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
分析 (1)乙醇催化氧化,生成乙醛和水;
(2)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;
(3)纤维素(C6H10O5)n燃烧生成二氧化碳和水;
(4)乙酸和乙醇与浓硫酸共热,酸脱羟基,醇脱氢生成酯和水.
解答 解:(1)乙醇中含-OH,能发生催化氧化生成乙醛,其反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O;
(2)电解饱和食盐水阳极上氯离子失电子发生氧化反应得到氯气,电解反应2Cl--2e-=Cl2↑,阴极上氢离子得到电子生成氢气,电解反应为2H++2e-=H2↑,总反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)纤维素(C6H10O5)n燃烧生成二氧化碳和水,反应的化学方程式为:(C6H10O5)n+6nO2$\stackrel{点燃}{→}$6nCO2+5nH2O,
故答案为:(C6H10O5)n+6nO2$\stackrel{点燃}{→}$6nCO2+5nH2O;
(4)乙酸和乙醇与浓硫酸共热,发生酯化反应,乙酸脱羟基,乙醇脱氢离子,反应为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
点评 本题考查化学反应方程式的书写,为高频考点,明确反应物与生成物即可解答,注意掌握常见的有机反应原理,常见有机物的性质,题目难度不大.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | KHSO4 | B. | Cu2(OH)2CO3 | C. | Ca(H2PO4)2 | D. | NH4NO3 |
| A. | 在甲、乙两烧杯的溶液中,共含有Cu2+、K-、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是:K+、OH-、CO32- | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的BaO2固体后,CH3COO-浓度变化最小 | |
| D. | 常温下水电离出的c(OH-)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
| A. | 氢氧根离子的电子式是 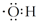 | |
| B. | 二氧化碳分子的比例模型是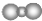 | |
| C. | 芳香烃的组成通式是CnH2n-6(n≥6) | |
| D. | 12C和14C的原子结构示意图均可表示为 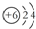 |
| A. | NO与O2反应 | B. | 碘加热升华 | C. | 氯酸钾加热分解 | D. | 氯化钠溶于水 |
| A. | 塑料凉鞋 | B. | 自行车内胎 | ||
| C. | 电线外面的塑料护套 | D. | 电熨斗的塑料部件 |
 .(若有配位键,用箭号表示)
.(若有配位键,用箭号表示)