题目内容
15.用NA表示阿伏伽德罗常数,下列有关说法正确的是( )| A. | lmol NH2-中含有9 NA个电子 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯分别在空气中充分燃烧,所耗用氧气的量依次减小 | |
| C. | 46g C2H5OH燃烧放出的热量为乙醇的燃烧热 | |
| D. | 常温下,56g铁粉与足量浓硝酸反应,电子转移数目为3NA |
分析 A、NH2-中含10个电子;
B、当质量相等时,H元素的百分含量越高,则耗氧量越高;
C、燃烧热是在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量;
D、常温下,铁在浓硫酸中会钝化.
解答 解:A、NH2-中含10个电子,故1molNH2-中含10NA个电子,故A错误;
B、当质量相等时,H元素的百分含量越高,则耗氧量越高,在甲烷、乙烯、1,3-丁二烯中,H元素的百分含量逐渐降低,故等质量时,三者的耗氧量逐渐降低,故B正确;
C、燃烧热是在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素必须转化为二氧化碳,H元素必须转化为液态水,故46g乙醇即1mol乙醇燃烧放出的热量不一定是乙醇的燃烧热,故C错误;
D、常温下,铁在浓硫酸中会钝化,反应程度很小,不能进行完全,则转移的电子数小于3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.下列关于能层与能级的说法中正确的是( )
| A. | 原子核外每一个能层最多可容纳的电子数为n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数等于该能层数 | |
| C. | 不同能层中s电子的原子轨道半径相同 | |
| D. | 不同能层中p电子的原子轨道能量相同 |
10.一定条件下,下列各组物质混合后(必要时可加热),两种反应物有可能恰好反应完全的是( )
| A. | 盐酸、MnO2 | B. | 铜片、浓硫酸 | C. | 大理石、硫酸 | D. | 银与硝酸 |
20.某化合物由A,B 2种元素组成,已知A,B两元素的质量比为7:4,相对原子质量之比为7:8,则此化合物分子式可能是( )
| A. | A2B | B. | AB | C. | AB2 | D. | A2B4 |
7.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖.下面有关叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N 与14N 互为同位素 | D. | 232Th转化成233U是化学变化 |
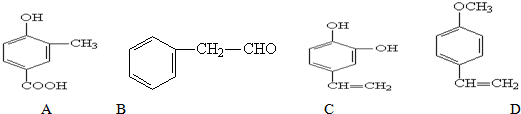
4.有关苯的结构和性质,下列说法正确的是( )
| A. |  与 与 是同分异构体 是同分异构体 | |
| B. |  此反应是取代反应 此反应是取代反应 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
5.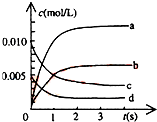 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量的浓度是0.0035mol/L;
(2)图中表示NO2的浓度变化曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a、v (NO2)=2v (O2)
b、容器内压强保持不变
c、v逆(NO)=v正(O2)
d、容器内混合气体的密度保持不变
e、该容器内颜色保持不变.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的浓度变化曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是be.
a、v (NO2)=2v (O2)
b、容器内压强保持不变
c、v逆(NO)=v正(O2)
d、容器内混合气体的密度保持不变
e、该容器内颜色保持不变.
 .
. .
.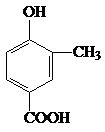 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.