题目内容
7.硝酸和硫酸是常见的两种酸,请回答下列问题:(1)浓H2SO4常用作气体干燥剂,是因为它具有吸水性.
(2)常温下可以用铝、铁制容器来盛装浓硝酸或浓硫酸,这是因为它们表面被氧化为致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应;金属铜与稀硝酸反应的离了方程式是8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O.若生成标准状况下11.2L气体,转移1.5mol电子.
分析 (1)浓硫酸具有吸水性,所以常用浓H2SO4作气体干燥剂;
(2)依据浓硫酸、浓硝酸都具有强的氧化性解答;金属铜与稀硝酸反应的离了方程式是8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O;生成标准状况下11.2L气体,物质的量为0.5mol,所以转移电子的物质的量为:0.5mol×3=1.5mol.
解答 解:(1)浓硫酸具有吸水性,所以常用浓H2SO4作气体干燥剂,故答案为:吸水性;
(2)浓硫酸、浓硝酸都具有强的氧化性,常温下能够使铁、铝钝化,形成致密氧化膜阻止反应进行,所以可以用铝、铁的容器盛装,金属铜与稀硝酸反应的离了方程式是8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O;生成标准状况下11.2L气体,物质的量为0.5mol,所以转移电子的物质的量为:0.5mol×3=1.5mol,
故答案为:它们表面被氧化为致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步反应;8H++2NO3-+3Cu═3Cu2++2NO↑+4H2O;1.5.
点评 本题考查了元素化合物知识,侧重考查浓硫酸、浓硝酸的性质,熟悉浓硫酸、浓硝酸的强的氧化性是解题关键,题目难度不大.

练习册系列答案
相关题目
17.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
18.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 0.5mol/L碳酸钠溶液中含有lmolNa+ | |
| B. | 14g氮气和一氧化碳混合气体中含原子总数为NA | |
| C. | 标准状况下,2.24LCCl4物质的量为0.1mol | |
| D. | 56g铁溶于过量的盐酸,电子转移数为3NA |
15.某下组同学欲研究SO2的性质.
(1)将相关的含硫物质分为如下表所示3组.第3组中物质X的化学式是H2SO4.
(2)利用如图所示的装置研究SO2的性质:
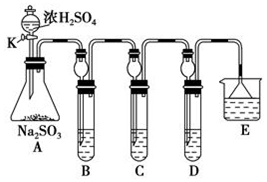
①在B中检验SO2的氧化性,则B中发生的化学反应方程式:SO2+2H2S=3S↓+2H2O.
②在C中装KMnO4溶液,目的是检验SO2的还原性,溶液逐渐褪色.生成Mn2+.同时pH降低.则C中反应的离子方程式为5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+.
③在D中有40mL2.5mol/LNaOH溶液,反应后增重4,则装置D中发生反应的总化学方程式是5SO2+8NaOH=3Na2SO3+2NaHSO3+3H2O.
(1)将相关的含硫物质分为如下表所示3组.第3组中物质X的化学式是H2SO4.
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO4、Na2SO3、NaHSO3 | SO3、X、Na2SO4、NaHSO4 |

①在B中检验SO2的氧化性,则B中发生的化学反应方程式:SO2+2H2S=3S↓+2H2O.
②在C中装KMnO4溶液,目的是检验SO2的还原性,溶液逐渐褪色.生成Mn2+.同时pH降低.则C中反应的离子方程式为5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+.
③在D中有40mL2.5mol/LNaOH溶液,反应后增重4,则装置D中发生反应的总化学方程式是5SO2+8NaOH=3Na2SO3+2NaHSO3+3H2O.
2.如图所示,下列实验操作方法正确的是( )
| A. |  检测容量瓶是否漏水的方法 | B. |  给溶液加热 | ||
| C. |  放回滴瓶 | D. |  过滤 |
12.下列说法正确的是( )
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 熵增且焓减的反应一定是自发的 | |
| C. | 凡是放热反应都是自发的,吸热反应都是非自发反应 | |
| D. | 自发反应一定是熵增加的,熵减小的反应都是非自发的 |
9.实验室中需要配制2mol/L的NaCl溶液450mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
| A. | 450mL,52.65g | B. | 500mL,58.5g | C. | 450mL,117g | D. | 500mL,52.3g |