题目内容
在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A、若生成1molFe,则放出a kJ热量 |
| B、若升高温度,则正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| C、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D、达到化学平衡状态时,若c(CO)=0.100 kJ/mol,则c(CO2)=0.0263 kJ/mol |
考点:化学平衡的计算
专题:
分析:A、由热化学方程式可知,生成1molFe,吸收的热量等于akJ;
B、升高温度,正、逆反应速率都增大,平衡向吸热反应移动;
C、该反应前后气体的物质的量不变,恒温条件下,压强始终不变;
D、根据平衡常数计算判断.
B、升高温度,正、逆反应速率都增大,平衡向吸热反应移动;
C、该反应前后气体的物质的量不变,恒温条件下,压强始终不变;
D、根据平衡常数计算判断.
解答:
解:A、由热化学方程式可知,生成1molFe,吸收的热量等于akJ,故A错误;
B、升高温度,正、逆反应速率都增大,该反应正反应是吸热反应,正反应速率增大更多,平衡向正反应移动,故B错误;
C、该反应前后气体的物质的量不变,恒温条件下,压强始终不变,故压强不变,不能说明到达平衡,故C错误;
D、该温度下K=
=0.263,若c(CO)=0.100mol/L,由平衡常数可知c(CO2)=0.1mol/L×0.263=0.0263mol/L,故D正确;
故选D.
B、升高温度,正、逆反应速率都增大,该反应正反应是吸热反应,正反应速率增大更多,平衡向正反应移动,故B错误;
C、该反应前后气体的物质的量不变,恒温条件下,压强始终不变,故压强不变,不能说明到达平衡,故C错误;
D、该温度下K=
| c(CO2) |
| c(CO) |
故选D.
点评:考查热化学方程式、化学平衡的影响因素、平衡状态的判断、平衡常数的有关计算等,难度中等,注意C选项中平衡状态的判断,选择判断的物理量随反应进行发生变化,当该物理量不再变化,说明到达平衡.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
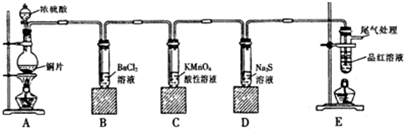
如表所示,提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | KNO3(NaCl) | 水 | 重结晶 |
| A、A | B、B | C、C | D、D |
下列物质反应过程中不会产生气体的是( )
A、 |
B、 |
C、 |
D、 |
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀.则该组离子可能是( )
| A、Na+、Ba2+、NO3-、CO32- |
| B、Ba2+、K+、Cl-、NO3- |
| C、Mg2+、NH4+、SO42-、Cl- |
| D、Fe2+、Na+、SO42-、NO3- |
在一密闭容器中,反应 aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则( )
| A、平衡向正反应方向移动了 |
| B、平衡向逆反应方向移动了 |
| C、物质B的质量分数增大了 |
| D、b>a |
八角茴香含有一种抗禽流感病毒的重要成分-莽草酸,其结构为: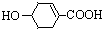 ,则莽草酸
,则莽草酸
不具有的性质是( )
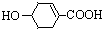 ,则莽草酸
,则莽草酸不具有的性质是( )
| A、遇FeCl3溶液呈紫色 |
| B、能发生消去反应 |
| C、能与H2发生加成反应 |
| D、1 mol莽草酸只能与1 mol NaOH反应 |
为检验FeCl2是否变质,可向溶液试样中加入( )
| A、NaOH溶液 | B、KSCN |
| C、铁粉 | D、石蕊试液 |