题目内容
【题目】(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下lmolCH3OH与02发生反应时,生成CO、CO2或HCHO的能量变化图[反应物02(g)和生成物H20(g)略去]。
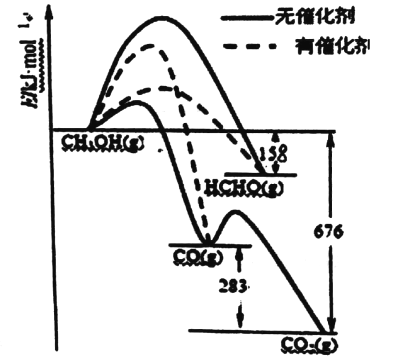
①写出1moLHCHO生成CO的热化学方程式:_______________。
②CH3OH与02在有催化剂作用下反应,产物中HCHO比率大大提高的原因是______________。
(2)—定温度下,将N2H4与N02以体积比为1:1置于10 L定容容器中发生反应 2N2H4(g)+2N02(g)![]() 3N2(g)+4H20(l) △H<0。下列能说明反应达到平衡状态的是______________。
3N2(g)+4H20(l) △H<0。下列能说明反应达到平衡状态的是______________。
a.混合气体密度保持不变
b.3v正(NO2)=2v逆(N2)
c.N2H4与N02体积比保持不变
d.体系压强保持不变
【答案】HCHO(g)+![]() O2(g)=CO(g)+H2O(g) △H=-235kJ·moL-1 催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能 abd
O2(g)=CO(g)+H2O(g) △H=-235kJ·moL-1 催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能 abd
【解析】
(1)由题中图示可得出HCHO生成CO的热化学方程式;
(2)催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能;
(3)根据判断平衡状态的依据进行分析。
(1)根据反应的能量图1molHCHO生成CO是放出(676-283-158)kJ=235kJ的热量,所以热化学方程式为:HCHO(g)+1/2O2(g)=CO(g)+H2O(g) △H=-235kJ/mol,
故答案为:HCHO(g)+1/2O2(g)=CO(g)+H2O(g) △H=-235kJ/mol。
(2)CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能,故答案为:催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能。
(3)a.反应中有液态水生成,如果反应没有达到平衡气体的密度会发生改变,故混合气体密度保持不变说明达到了平衡状态,故a正确;
b.根据反应中化学计量数的关系有:3v正(NO2)=2v正(N2),联立3v正(NO2)=2v逆(N2),得v正(N2)=v逆(N2),同种物质的生成和消耗数率相等,反应达到了平衡,故b正确;
c.N2H4与NO2以体积比1:1投入,反应时也以1:1反应,故N2H4与NO2体积比始终为1:1,不能判断达到了平衡,故c错误;
d.反应是气体体积改变的反应,压强不变,说明反应达到了平衡状态,故d正确。
故答案为:abd。