题目内容
【题目】实验室中可以利用反应KClO3+6HCl═KCl+3Cl2↑+3H2O来制取氯气。
(1)用双线桥标出该反应中电子转移的方向和数目_____________________KClO3+6HCl(浓)═KCl+3Cl2+3H2O
(2)该反应中还原剂是_____,还原产物是______.
(3)若有1molHCl完全反应,则转移的电子得到物质的量是_______mol
【答案】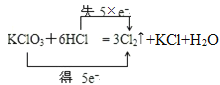 HCl Cl2
HCl Cl2 ![]()
【解析】
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3中Cl元素的化合价由+5价降低为0,HCl中Cl元素的化合价由-1价升高为0。
(1)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ;
;
(2)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,HCl中Cl元素的化合价由-1价升高为0,失去电子被氧化,HCl作还原剂,对应的氯气为氧化产物;
KClO3中Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,氯气既是氧化产物又是还原产物,
该反应中还原剂是HCl,还原产物是Cl2;
(3)反应中6molHCl参加反应,只有5mol被氧化,所以,若有1molHCl完全反应,则转移的电子得到物质的量是![]() 。
。

练习册系列答案
相关题目