题目内容
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H20(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
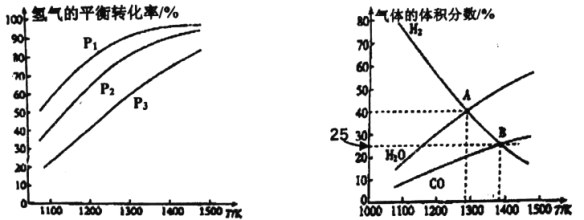
(a)不同压强下温度与H2平衡转化率的关系 (b)0.1MPa下温度与平衡时气体成分的关系
(1)由图(a)可知,该反应△H_______0(填“>”或“<”),p1、p2、p3由大到小的顺序为_______;
(2)由图(b)可知,B点时H2的平衡转化率为_______;
(3)A点对应的平衡常数K=_______(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】> p1<p2<p3 66.7% 4×10-4
【解析】
(1)升高温度平衡向吸热反应方向移动,增大压强平衡向气体总物质的量减小的方向移动;
(2)根据三段式求氢气的转化率;
(3)图1中A点氢气和水蒸气的体积分数相等,均为40%,而由反应方程式可知一氧化碳的体积分数为水蒸气的一半,即为20%,说明氢气、一氧化碳、水蒸气的物质的量之比为2:1:2,由此根据表达式求Kp。
(1)升高温度平衡向吸热反应方向移动,由图像(a)可知升高温度,氢气的转化率增大,说明平衡正向移动,正反应为吸热反应,即该反应的△H>0,增大压强平衡向气体总物质的量减小的方向移动,对MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)可知,增大压强平衡逆向移动,氢气的转化率降低,则由图像(a)可知p1<p2<p3,故答案为:>;p1<p2<p3。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)可知,增大压强平衡逆向移动,氢气的转化率降低,则由图像(a)可知p1<p2<p3,故答案为:>;p1<p2<p3。
(2)由图(b)可知,B点时H2的体积分数为25%,设起始时氢气的物质的量为1mol,此时氢气的转化率为α,则
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)
起始(mol) 1 0 0
变化(mol) α 0.5α α
平衡(mol) 1-α 0.5α α
1-α/(1+0.5α)=0.25,解得α=66.7%,即b点时氢气的平衡转化率为66.7%,故答案为:66.7%。
(3)图1中A点氢气和水蒸气的体积分数相等,均为40%,而由反应方程式可知一氧化碳的体积分数为水蒸气的一半,即为20%,说明氢气、一氧化碳、水蒸气的物质的量之比为2:1:2,Kp=(2/5×0.1)4(1/5×0.1)2/(2/5×0.1)4=4×10-4,故答案为:4×10-4。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案