题目内容
18.(1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是:整个反应容器必须保温、准确测定出反应前后的温差(2)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应.请配平:
□MnO4-+□H++□H2C2O4═□Mn2++□CO2↑+□H2O
该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:Mn2+的自催化作用
(3)人们常常根据反应的特征现象来判断反应进行的快慢.对于下列反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O 通常测定在一定条件下单位时间内出现硫单质产生的浑浊(明显)现象来比较该反应进行的快慢.为增大上述反应的速率,可采取的不同措施有:升温,增大反应物的浓度.
分析 (1)中和热测定需要保温、准确测定反应前后的温度;
(2)Mn元素的化合价降低,C元素的化合价升高,结合电子、电荷守恒配平,生成的锰离子可催化该反应;
(3)该反应生成S沉淀可确定反应速率,浓度、温度均影响反应速率,以此来解答.
解答 解:(1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是整个反应容器必须保温(或尽可能减少热量的损失)、准确测定出反应前后的温差等,
故答案为:整个反应容器必须保温;准确测定出反应前后的温差;
(2)MnO4-+H++H2C2O4→Mn2++CO2↑+H2O中,Mn元素的化合价降低,C元素的化合价升高,由电子、电荷守恒可知离子反应为2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是Mn2+的自催化作用,
故答案为:2;6;5;2;10;8;Mn2+的自催化作用;
(3)人们常常根据反应的特征现象来判断反应进行的快慢.对于下列反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O 通常测定在一定条件下单位时间内出现硫单质产生的浑浊(明显)现象来比较该反应进行的快慢.为增大上述反应的速率,可采取的不同措施有,
故答案为:硫单质产生的浑浊;升温;增大反应物的浓度.
点评 本题考查氧化还原反应及反应速率,为高频考点,把握中和热测定、速率影响因素、反应配平为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
8.酸雨形成的主要原因是( )
| A. | 森林遇到乱砍滥伐,破坏了生态平衡 | |
| B. | 工业上大量燃烧含硫燃料 | |
| C. | 硫酸厂排出的大量气体 | |
| D. | 大气中CO2的含量增多 |
9.下列反应中气体只作氧化剂的是( )
| A. | Cl2通入水中 | B. | Cl2通入水Na2SO3溶液中 | ||
| C. | 二氧化硫通入氯水中 | D. | NO2通入水中 |
6.下列离子方程式中正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 向氯化亚铁溶液中加入氯水:Fe2++Cl2═Fe3++2Cl- | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
13.在恒温恒容的密闭容器中加入1molX和2molY,发生如下反应:X(g)+2Y(g)?2Z(g),该反应达到平衡的标志是( )
| A. | 混合气体的密度不再随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为:1:2:2 | |
| C. | 单位时间消耗0.1molX,同时生成0.2molY | |
| D. | 单位时间消耗0.1molX,同时生成0.2molZ |
3.一澄清透明的溶液中,已知各离子的浓度相等,可能含有的阳离子有Na+、Fe2+、Ba2+、NH4+,可能含有的阴离子有Cl-、NO3-、CO32-、SO42-.向该混合溶液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变.下列叙述正确的是( )
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |
7.为检验某溶液中的离子,下列操作方法及结论正确的是( )
| A. | 加入氯水,再加入KSCN溶液,溶液显红色,则溶液中一定含有Fe2+ | |
| B. | 加入盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| C. | 加入Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则溶液中一定含有SO42- | |
| D. | 加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+ |
8.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH═K2FeO4+2NaOH,下列说法不正确的是( )
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中NaClO是氧化剂 | |
| C. | Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2molFeCl3发生反应,转移电子的物质的量为6mol |
 、
、 .
. .
. 、
、 .
. 、
、
 +
+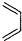 $\stackrel{△}{→}$
$\stackrel{△}{→}$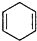 ,如果要合成
,如果要合成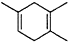 所用的原始原料可以是AC
所用的原始原料可以是AC