题目内容
12.用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:(1)准确称取一定量的样品,配成500mL待测溶液.称量时,样品应放在A上称量.
A.小烧杯 B.洁净纸片 C.天平的托盘
(2)试验时用0.2000mol•L-1的盐酸来滴定待测样品溶液,通常不会选用B作指示剂.
A.甲基橙 B.石蕊 C.酚酞
(3)若选用酚酞作指示剂,到达滴定终点的实验现象是当加入最后一滴盐酸时,锥形瓶内溶液刚好由淡红色变为无色且半分钟无颜色变化,这样操作所得实验数据偏小(填“偏大”、“偏小”或“无影响”,下同);若观察酸式滴定管液面时,开始俯视,滴定终点平视,则实验数据偏大.
(4)根据如表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol•L-1.
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
分析 (1)NaOH具有腐蚀性,一般在小烧杯中称量;
(2)盐酸滴定碱,选择酚酞或甲基橙作指示剂;
(3)若选用酚酞作指示剂,碱遇酚酞变红,滴定终点变为无色,溶液的pH约为8;若观察酸式滴定管液面时,开始俯视,滴定终点平视,V(盐酸)偏大;
(4)第三次误差较大,舍弃,则V(盐酸)=$\frac{(20.50-0.4)+(24.00-4.10)}{2}$=20.0mL,结合V(盐酸)c(盐酸)=V(NaOH)c(NaOH)计算.
解答 解:(1)准确称取一定量的样品,配成500mL待测溶液.称量时,样品应放在小烧杯中称量,故答案为:A
(2)盐酸滴定碱,选择酚酞或甲基橙作指示剂,不能选石蕊,不易判断滴定终点颜色变化,误差较大,故答案为:B;
(3)若选用酚酞作指示剂,碱遇酚酞变红,滴定终点变为无色,则到达滴定终点的实验现象是当加入最后一滴盐酸时,锥形瓶内溶液刚好由淡红色变为无色且半分钟无颜色变化,此时溶液的pH约为8,消耗酸较少,由V(盐酸)c(盐酸)=V(NaOH)c(NaOH)可知,c(NaOH)偏小;若观察酸式滴定管液面时,开始俯视,滴定终点平视,V(盐酸)偏大,由V(盐酸)c(盐酸)=V(NaOH)c(NaOH)可知,c(NaOH)偏大,
故答案为:当加入最后一滴盐酸时,锥形瓶内溶液刚好由淡红色变为无色且半分钟无颜色变化;偏小; 偏大;
(4)第三次误差较大,舍弃,则V(盐酸)=$\frac{(20.50-0.4)+(24.00-4.10)}{2}$=20.0mL,由V(盐酸)c(盐酸)=V(NaOH)c(NaOH)可知,0.02L×0.2=0.01L×c(NaOH),解得c(NaOH)=0.4000mol/L,
故答案为:0.4000.
点评 本题考查中和滴定实验,为高频考点,把握滴定原理、实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意指示剂的选择及误差分析,题目难度不大.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案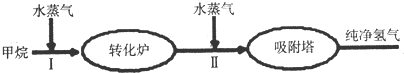
(1)此流程的第Ⅱ步反应为:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$;反应的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)此流程的第Ⅱ步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,以表格的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号)
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |

A.t2时加入了催化剂 B.t3时降低了温度 C.t3时增大了压强.
| A. | 物质的量是一个新的物理量,它表示的是物质的质量 | |
| B. | 周一上午升旗仪式时,学生和老师的物质的量共有2mol | |
| C. | 物质的量的单位是摩尔,简称摩,用mol表示 | |
| D. | 水的摩尔质量是18g |

| A. | 只有① | B. | ②③ | C. | 只有③ | D. | 全部 |
| A. | K、L、M、N | B. | s、p、d、f | C. | px、py、pz | D. | ↑、↓ |

