题目内容
1.下列仪器能用于物质分离的是( )| A. | 普通漏斗 | B. | 试管 | C. | 天平 | D. | 分液漏斗 |
分析 常用于分离的操作方法有蒸发、过滤、分液、蒸馏等,以此选择使用仪器.
解答 解:A.普通漏斗用于过滤操作,分离固体和液体,故A正确;
B.试管常用于物质的制备、发生装置,故B错误;
C.托盘天平用来称量药品的仪器,故C错误;
D.分液漏斗用于分液操作,分离互不相溶的液体,故D正确.
故选AD.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,常见物质的分离操作以及使用的范围,难度不大,注意相关基础知识的积累.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
11.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O═6Cu+SO2↑,关于该反应的说法中,正确的是( )
| A. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| B. | 该反应的氧化剂只有Cu2O | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 每生成19.2gCu,反应中转移1.8mol电子 |
12. 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | NaAlO2 | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | Al2O3 | 两性氧化物 | 氧化物 |
| D | 单质参与反应 | 置换反应 | 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
9.对于下列常见化学原理的认识错误 的是( )
| A. | 明矾可用作净水剂 | |
| B. | 酒精可用于杀菌、消毒 | |
| C. | 碳酸钙是陶瓷文物的主要成分 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
16.下列物质的主要成分是二氧化硅的是( )
| A. | 光导纤维 | B. | 水晶 | C. | 玛瑙 | D. | 硅石 |
6.下列关于能源和作为能源使用的物质的叙述中,错误的是( )
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 太阳能不能直接转化为电能 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能等为人类所用 | |
| D. | 绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来 |
13.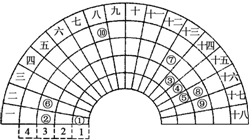 元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
 元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应原子半径依次增大 | |
| B. | ②、⑨的氢化物晶体类型相同 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |
10. 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为离子键、共价键.
(2)已知:①E-E→2E•;△H=+a kJ•mol-1
②2A•→A-A;△H=-b kJ•mol-1
③E•+A•→A-E;△H=-c kJ•mol-1(“•”表示形成共价键所提供的电子)写出298K时,A2与E2反应的热化学方程式(用化学式表示)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1.
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g);△H=-d kJ•mol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则该时间段内A2的平均反应速率v(A2)=0.125mol/(L.min).
②该温度下此反应的平衡常数K的值为4.
③三个容器中的反应分别达平衡时各组数据关系正确的是ADE(填序号).
A.α1+α2=1 B.α3<α1 C. n2<n3<1.0mol
D.P3<2P1=2P2 E. Q1+Q2=d F.Q3=2Q1
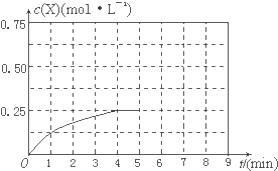
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在图中画出第5min 到新平衡时X的物质的量浓度的变化曲线.
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.(1)A、C、D形成的化合物中含有的化学键类型为离子键、共价键.
(2)已知:①E-E→2E•;△H=+a kJ•mol-1
②2A•→A-A;△H=-b kJ•mol-1
③E•+A•→A-E;△H=-c kJ•mol-1(“•”表示形成共价键所提供的电子)写出298K时,A2与E2反应的热化学方程式(用化学式表示)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1.
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g);△H=-d kJ•mol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②该温度下此反应的平衡常数K的值为4.
③三个容器中的反应分别达平衡时各组数据关系正确的是ADE(填序号).
A.α1+α2=1 B.α3<α1 C. n2<n3<1.0mol
D.P3<2P1=2P2 E. Q1+Q2=d F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在图中画出第5min 到新平衡时X的物质的量浓度的变化曲线.
2.下列过程属于人工固氮的是( )
| A. | 用N2和H2合成NH3 | B. | 闪电时大气中氮的氧化物的生成 | ||
| C. | 由氨制尿素 | D. | 从空气中分离出氮气 |