题目内容
5.海带中含有丰富的碘元素,在实验室中,我们可以用海带通过多步实验制成碘水,下列说法正确的是( )| A. | 该实验过程中要用到氧化剂 | |
| B. | 检验碘单质是否存在,可用碘化钾溶液 | |
| C. | 要萃取碘水中的碘,可以用汽油或酒精 | |
| D. | 利用如图所示装置不能分离食盐和晶体碘的混和物 |
分析 A.把碘离子转化为单质碘,I元素的化合价会升高;
B.单质碘遇到淀粉溶液会变蓝色;
C.酒精与水互溶,不能作萃取剂;
D.食盐受热不挥发也不分解,单质碘受热易升华.
解答 解:A.把碘离子转化为单质碘,I元素的化合价会升高,所以该实验过程中要用到氧化剂把碘离子氧化为单质碘,故A正确;
B.单质碘遇到淀粉溶液会变蓝色,所以检验碘单质是否存在,可用淀粉溶液,不能用碘化钾溶液,故B错误;
C.酒精与水互溶,不能作萃取剂,所以要萃取碘水中的碘,可以用汽油,但是不能用酒精,故C错误;
D.食盐受热不挥发也不分解,单质碘受热易升华,所以利用如图所示装置能分离食盐和晶体碘的混和物,在盛有冷水的烧瓶的底部接收得到的是单质碘,烧杯中剩余的是食盐,故D错误.
故选A.
点评 本题考查了氧化还原反应、物质的检验、分离提纯的基本操作等,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大,注意把握常见的分离提纯的方法.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
15.某有机物能使溴的CCl4溶液褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中通常含有的基团的组合是( )
| A. | 卤素原子、碳碳双键 | B. | 羟基、羧基 | ||
| C. | 醛基、酯基 | D. | 碳碳双键、酯基 |
13.下列溶液中,氯离子的物质的量浓度是3mol•L-1的是( )
| A. | 200mL 3mol•L-1 NaClO3溶液 | B. | 100mL 2mol•L-1 FeCl3溶液 | ||
| C. | 150mL 3mol•L-1 KCl溶液 | D. | 150mL 1mol•L-1 MgCl2溶液 |
20.下列有关说法正确的是( )
| A. | 将一小块钠投入硫酸铜溶液,会析出紫红色的铜 | |
| B. | 将金属钠放置在空气中,最终转化为碳酸钠 | |
| C. | 铁在氧气中燃烧,可以得到红色的三氧化二铁 | |
| D. | 硫在过量的氧气中燃烧,可以得到产物SO3 |
17. 如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )
如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )
 如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )
如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1.下列叙述错误的是( )| A. | X和Z氢化物的热稳定性和还原性均依次减弱 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 |
18.反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )
| A. | 升高温度,正反应速率增加,逆反应速率减小 | |
| B. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| C. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |

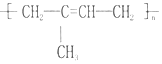 的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2.
的名称聚2-甲基-1,3-丁二烯,其单体的结构简式CH2═C(CH3)CH═CH2. .
. .
. .
.