题目内容
8.下列有关实验操作、现象和解释或结论都正确的是( )| 选项 | 实验操作与现象 | 解释或结论 |
| A | 过量的铁粉中加入稀硝酸中,充分反应后,滴入KSCN溶液,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | AgI固体中滴入KCl溶液,沉淀由黄色变为白色 | AgI比AgCl难溶 |
| C | 铝箔插入稀硝酸中,无现象 | 铝箔表面被硝酸氧化,形成致密的氧化膜 |
| D | 苯酚溶液中滴加溴水,出现白色沉淀 | 苯酚易发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.过量铁粉,反应生成亚铁离子;
B.沉淀向溶解度更小的方向转化;
C.常温下,浓硝酸和铝发生钝化现象;
D.苯酚与溴发生反应生成2,4,6-三溴苯酚,为白色沉淀.
解答 解:A.过量铁粉,反应生成亚铁离子,加入KSCN溶液、溶液不显红色,故A错误;
B.沉淀向溶解度更小的方向转化,AgI比AgCl难溶,不发生转化,故B错误;
C.常温下,浓硝酸和铝发生钝化现象,稀硝酸和铝反应生成硝酸铝和NO,有气体生成且铝片逐渐溶解,故C错误;
D.苯酚与溴发生反应生成白色沉淀2,4,6-三溴苯酚,为取代反应,故D正确.
故选D.
点评 本题考查较为综合,涉及氧化还原反应,沉淀转化以及取代反应等知识,综合考查学生的分析能力、实验能力和评价能力,为高考常见题型,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
19.下列关于乙烯和聚乙烯的叙述中正确的是( )
| A. | 二者互为同系物 | |
| B. | 聚乙烯是乙烯的缩聚产物 | |
| C. | 二者都能使溴的四氯化碳溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯分别完全燃烧消耗等物质的量的氧气,生成等量的水 |
16.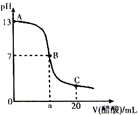 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
13.下面是一些常见分子的比例模型.其中1个分子中含有共用电子对最多的是( )
| A. |  氢气 氢气 | B. |  氨气 氨气 | C. |  水 水 | D. |  二氧化碳 二氧化碳 |
17.下列图示与对应的叙述相符的是( )
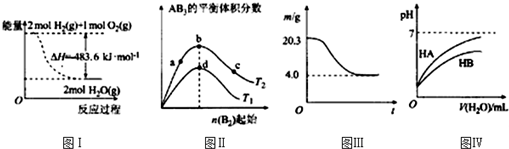

| A. | 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 图Ⅱ表示反应A2(g)+3B2(g)?2AB3(g),达到平衡时A2的转化率大小为:b>a>c | |
| C. | 图Ⅲ表示0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 的名称是1,3-二甲基苯
的名称是1,3-二甲基苯