题目内容
7.下列操作不正确的是( )| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 含不溶性杂质的粗苯甲酸进行重结晶分离的操作步骤之一是趁热过滤 | |
| C. | 向溴乙烷中加入NaOH溶液,加热后滴加AgNO3溶液,检验其中的溴元素 | |
| D. | 做银镜反应实验后,用硝酸洗涤试管壁上的银镜 |
分析 A.水与电石反应较快,饱和食盐水可减缓反应速率;
B.温度低时苯甲酸的溶解度小;
C.溴乙烷中加入NaOH溶液,发生水解反应,检验溴离子应在酸性条件下;
D.Ag与硝酸反应.
解答 解:A.水与电石反应较快,饱和食盐水可减缓反应速率,则有效控制产生乙炔的速率,故A正确;
B.温度低时苯甲酸的溶解度小,则重结晶分离的操作步骤之一是趁热过滤,防止苯甲酸损失,故B正确;
C.溴乙烷中加入NaOH溶液,发生水解反应,检验溴离子应在酸性条件下,没有加硝酸至酸性,不能检验,故C错误;
D.Ag与硝酸反应,则用硝酸洗涤试管壁上的银镜,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、离子检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
17.下列物质既含离子键又含共价键的是( )
①CCl4
②Na2O2
③H2SO4
④NH4Cl
⑤H2O2
⑥Ca(OH)2.
①CCl4
②Na2O2
③H2SO4
④NH4Cl
⑤H2O2
⑥Ca(OH)2.
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
18.生活中有机化合物随处可见.以下生活中提到物质的主要成分不属于高分子化合物的是( )
| A. | 蚕食被中含有的蚕丝 | B. | 大豆油、猪油中含有的油脂 | ||
| C. | 五谷杂粮中含有的淀粉 | D. | 棉质衣服中的纤维素 |
15.下列实验操作不正确的是( )
| 实验目的 | 实验操作 | |
| A | 验证化学反应中的能量变化 | 将NO2球浸泡在冰水,热水中观察颜色变化 |
| B | 证明非金属性:Cl>C>Si | 将纯碱与足量浓盐酸反应后产生的气体直接通入硅酸钠溶液中 |
| C | 探究相同条件下,溶液浓度对反应速率的影响 | 在两支试管中各加入4mL 0.01mol/L的KMnO4 酸性溶液,再分别加入0.1mol/L H2C2O4 溶液2mL、0.2mol/L H2C2O4溶液2mL,分别记录溶液褪色所需时间 |
| D | 除去氢氧化铁中少量的氢氧化铜 | 将过量氨水加入混合物中并充分搅拌,然后过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
2.下列表达正确的是( )
| A. | 羟基的电子式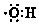 | B. | 醛基的结构简式-COH | ||
| C. | 2-丁烯的键线式  | D. | 2-丙醇的结构简式 C3H7-OH |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24L戊烷所含分子数为0.1 NA | |
| B. | 78gNa2O2固体与足量的H2O反应转移的电子数为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 2.0gH218O和D216O的混合物中所含中子数为NA |
 .
.