题目内容
孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O的步骤如下:

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
(1)“除杂”时先通入足量H2O2将Fe2+氧化成Fe3+,再加入CuO固体.其中加入CuO作用是 ,需调节溶液pH的范围为 .
(2)操作X包括 、过滤和洗涤等.在进行该操作时,需要将溶液B再适当酸化目的是: .
(3)为准确测定溶液A中含有Fe2+的物质的量浓度,实验如下:
①取出25.00mL溶液A,配制成250mL 溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.20mol/LKMnO4溶液装入 (填仪器名称),记录数据.重复滴定3次.平均消耗KMnO4溶液V mL.(注:反应式:5Fe2++MnO4-+10H+=5Fe3++Mn2++5H2O)
该滴定的滴定终点判断依据是: .
③计算溶液A中c(Fe2+)= mol/L (只列出算式,不做运算).

为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)操作X包括
(3)为准确测定溶液A中含有Fe2+的物质的量浓度,实验如下:
①取出25.00mL溶液A,配制成250mL 溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.20mol/LKMnO4溶液装入
该滴定的滴定终点判断依据是:
③计算溶液A中c(Fe2+)=
考点:难溶电解质的溶解平衡及沉淀转化的本质,铜金属及其重要化合物的主要性质,探究物质的组成或测量物质的含量
专题:电离平衡与溶液的pH专题
分析:孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀盐酸反应后生成二氧化碳气体,得到溶液氯化铜溶、氯化亚铁液A,过滤得到二氧化硅固体,“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液pH沉淀铁离子过滤得到滤液为氯化铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到氯化铜晶体;
(1)分析图表数据,加入氧化铜调节溶液PH保证铁离子全部沉淀,铜离子不沉淀;
(2)溶液中得到溶质的方法是蒸发浓缩冷却结晶、过滤洗涤;
(3)②酸性高锰酸钾具有很强的氧化性,能够腐蚀橡皮管,应盛放在酸式滴定管中;酸性高锰酸钾溶液显紫红色,滴定终点,高锰酸钾不再褪色;
③据离子方程式5Fe2++MnO4-+10H+=5Fe3++Mn2++5H2O和消耗高锰酸钾的量计算c(Fe2+).
(1)分析图表数据,加入氧化铜调节溶液PH保证铁离子全部沉淀,铜离子不沉淀;
(2)溶液中得到溶质的方法是蒸发浓缩冷却结晶、过滤洗涤;
(3)②酸性高锰酸钾具有很强的氧化性,能够腐蚀橡皮管,应盛放在酸式滴定管中;酸性高锰酸钾溶液显紫红色,滴定终点,高锰酸钾不再褪色;
③据离子方程式5Fe2++MnO4-+10H+=5Fe3++Mn2++5H2O和消耗高锰酸钾的量计算c(Fe2+).
解答:
解:(1)分析图表数据,加入氧化铜调节溶液PH,使溶液的pH升高,促进Fe3+水解生成Fe(OH)3沉淀,铜离子不沉淀,需要控制的溶液PH=3.2~4.7.
故答案为:与溶液中H+反应,使溶液的pH升高,促进Fe3+水解生成Fe(OH)3沉淀;3.2~4.7;
(2)操作X是溶液中得到溶质的方法是蒸发浓缩冷却结晶、过滤洗涤,适当酸化目的是抑制铜离子水解,故答案为:蒸发浓缩;冷却结晶;抑制Cu2+的水解;
(3)②酸性高锰酸钾具有很强的氧化性,能够腐蚀橡皮管,应盛放在酸式滴定管中;酸性高锰酸钾溶液显紫红色,滴定终点,高锰酸钾不再褪色,故答案为:酸式滴定管;当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好变为紫红色且半分钟不变色;
③氧化25.00mL稀释好的溶液,反应消耗的高锰酸钾物质的量为:0.20mol/L×V×10-3L,据离子方程式5Fe2++MnO4-+10H+=5Fe3++Mn2++5H2O可知,反应掉亚铁离子物质的量为5×0.20×V×10-3mol,则原25.00mL溶液中含亚铁离子物质的量为
×5×0.20×V×10-3mol,其物质的量浓度为
mol/L,
故答案为:
.
故答案为:与溶液中H+反应,使溶液的pH升高,促进Fe3+水解生成Fe(OH)3沉淀;3.2~4.7;
(2)操作X是溶液中得到溶质的方法是蒸发浓缩冷却结晶、过滤洗涤,适当酸化目的是抑制铜离子水解,故答案为:蒸发浓缩;冷却结晶;抑制Cu2+的水解;
(3)②酸性高锰酸钾具有很强的氧化性,能够腐蚀橡皮管,应盛放在酸式滴定管中;酸性高锰酸钾溶液显紫红色,滴定终点,高锰酸钾不再褪色,故答案为:酸式滴定管;当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好变为紫红色且半分钟不变色;
③氧化25.00mL稀释好的溶液,反应消耗的高锰酸钾物质的量为:0.20mol/L×V×10-3L,据离子方程式5Fe2++MnO4-+10H+=5Fe3++Mn2++5H2O可知,反应掉亚铁离子物质的量为5×0.20×V×10-3mol,则原25.00mL溶液中含亚铁离子物质的量为
| 250 |
| 25.00 |
0.20×V×10-3×5×
| ||
| 25×10-3 |
故答案为:
0.20×V×10-3×5×
| ||
| 25×10-3 |
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
相关题目
下列实验事实不能用平衡移动原理解释的是( )
A、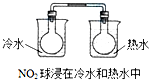 | ||||||||
B、
| ||||||||
C、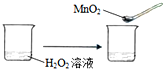 | ||||||||
D、
|
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、K+、Na+、NO3-、SiO32- |
| B、K+、Na+、Ba2+、SO42- |
| C、K+、Ca2+、Na+、CO32- |
| D、H+、NH4+、K+、Cl- |
下列物质性质与应用对应关系正确的是( )
| A、二氧化锰具有还原性,可用于实验室制备氯气 |
| B、Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 |
| C、碳酸氢钠能与碱反应,可用作食品的膨松剂 |
| D、Na2SO4浓溶液能使蛋白质发生盐析,可用于杀菌、消毒 |
除去NaCl溶液中混有的Ca2+、Mg2+、SO42-、HCO3-等杂质,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④盐酸,加入试剂顺序合理的是( )
| A、④②①③ | B、①③②④ |
| C、③②①④ | D、①②③④ |

 ,其工业合成路线如下:
,其工业合成路线如下:

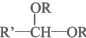 +H2O在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式.
+H2O在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式.