题目内容
3.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.
(1)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同?相同(填“相同”或“不相同”);
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式Cl2+H20+S2O32-=SO42-+S↓+2Cl-+2H+.
分析 (1)根据SO2和Cl2的化学性质分析反应现象,从而判断反应现象是否相同;
(2)先根据X中元素的质量之比求出原子个数之比,再根据题中反应现象判断该反应生成的离子,由氧化还原反应写出离子方程式.
解答 解:(1)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色,
故答案为:相同;
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3,所以X中S和O的原子个数比为$\frac{4}{32}$:$\frac{3}{16}$=2:3,所以该离子为S2O3 2-;氯气有强氧化性,能和硫代硫酸根离子发生氧化还原反应,根据题意知,该反应中有硫酸根离子生成,所以氯气中氯元素得电子生成氯离子,所以该反应的离子方程式为:Cl2+H20+S2O32-=SO42-+S↓+2Cl-+2H+,
故答案为:Cl2+H20+S2O32-=SO42-+S↓+2Cl-+2H+.
点评 本题考查了实验装置的综合应用,题目难度中等,涉及离子方程式书写、性质实验方案的设计与评价等知识点,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 化学家不可以制造出自然界不存在的材料 | |
| B. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| C. | Na2O2与水反应只能生成碱 | |
| D. | 高性能通信材料光导纤维的主要原料是硅 |
11.下列实验方案能达到目的( )
| A. |  除去CO中的CO2 | B. | 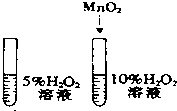 探究二氧化锰对反应速率的影响 | ||
| C. | 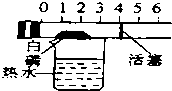 探究空气中氧气的含量 | D. |  探究溶解性的影响因素 |
12.下列离子方程式书写正确的是( )
| A. | Na投入到水中:Na+H2O═Na++OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Al2O3和NaOH溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
13.下列鉴别物质的方法中,不正确的是( )
| A. | 用澄清石灰水鉴别SO2和CO2 | |
| B. | 用KSCN溶液鉴别FeCl2和FeCl3溶液 | |
| C. | 用焰色反应鉴别NaCl溶液和KCl溶液 | |
| D. | 用过量的NaOH溶液鉴别AlCl3溶液和MgCl2溶液 |
 如图是用浓硝酸、稀硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.
如图是用浓硝酸、稀硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置.